ユビキチン化による炎症・免疫シグナルの時空間制御とその数理シミュレーション
研究分担者
山本瑞生
東京大学 医科学研究所 アジア感染症研究拠点 特任講師
http://www.traf6.com
研究概要
NF-κBが関与する炎症と乳癌悪性化の数理シミュレーション
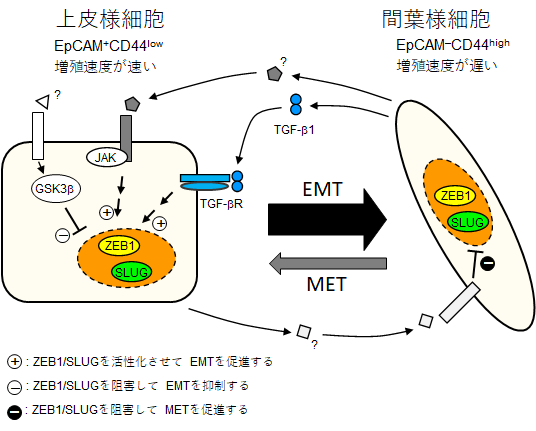
乳癌は発現プロファイルによっていくつかのサブタイプに分類される。ホルモン受容体(ER、PR)を発現するLumina-like乳癌や、ERBB2を発現するERBB2-enriched乳癌は近年、エストロジェン拮抗薬や抗ERBB2抗体療法によって予後の改善が見られているが、これらを発現しないTriple negative乳癌(TNBC)は古典的な抗癌剤治療に頼らざるを得ず予後が悪い。我々はこのTNBCに分類されるBasal-like乳癌やClaudin-low乳癌の悪性化機構の解析を進めている。
我々はこれまでにBasal-like乳癌において炎症性サイトカインの刺激やエピゲノム異常による転写因子NF-κBの恒常的活性化がNOTCHシグナルのリガンドであるJAG1発現を誘導して細胞間相互作用による乳癌幹細胞の維持に寄与していることを明らかにしてきた。さらに、いくつかのBasal-like乳癌細胞株において通常培養下で上皮間葉転換(Epithelial-Mesenchymal Transition, EMT)とその逆過程であるMETが誘導され、常に上皮様細胞と間葉様細胞が共存していることを明らかにした。さらにお互いが産生する因子によってこの割合が制御されていることから細胞間相互作用の重要性を見出した。
上皮系細胞は活発に増殖して原発巣の肥大に寄与する一方、間葉系細胞は増殖能は低いものの抗癌剤に抵抗性を示し活発に運動して転移や浸潤を引き起こすため、これらのバランスを制御する機構を理解することで癌悪性化に対する新たな治療法の提唱に繋がると考えられる。
このような背景から、炎症性因子が乳癌悪性化に与える影響について細胞の多様性やシグナル伝達に着目して数理シグナル領域の他班と連携して以下の解析を進める。
(1)生細胞における上皮・間葉状態を可視化するレポーター細胞株を用いてBasal-like乳癌における自発的EMT-METによる集団内の上皮様細胞と間葉様細胞の時間的・空間的な存在を解析して数理シミュレーションを行う。さらに炎症性のサイトカインや転写因子の活性化をモニタリングしてパラメーターとすることで、腫瘍組織中における炎症と上皮間葉転換の関連を解析可能な数理モデルを作成する。
(2)近年EMTは多段階の細胞の性質変化であることが提唱され、各段階の細胞の性質や重要な因子の同定が進められている。我々が発見した乳癌細胞における自発的EMT-METにおいても中間段階の細胞の存在が示唆されている。そこで各段階を規定するマーカー遺伝子や変化に重要な遺伝子・シグナル伝達を同定することで、より実際の腫瘍中におけるEMT-METの変化に忠実な数理モデルの構築が可能になると考えられる。実際にはCRISPR/Cas9を用いた網羅的遺伝子スクリーニングを行い、自発的なEMT-METに関する遺伝子やシグナル伝達を網羅的に解析し、数理モデルへの応用を検討する。このモデルを用いて炎症と乳癌悪性化の数理シミュレーションを試みる。
参考文献
- Yamamoto M, Abe C, Wakinaga S, Sakane K, Yumiketa Y, Taguchi Y, Matsumura T, Ishikawa K, Fujimoto J, Semba K, Miyauchi M, Akiyama T, Inoue JI. TRAF6 maintains mammary stem cells and promotes pregnancy-induced mammary epithelial cell expansion. Commun Biol. 2:292, (2019).
- Tagaya H, Ishikawa K, Hosokawa Y, Kobayashi S, Ueoka Y, Shimada M, Ohashi Y, Mikami H, Yamamoto M, Ihara T, Kumazawa K, Sugihara K, Goshima N, Watanabe S, Semba K. A method of producing genetically manipulated mouse mammary gland. Breast Cancer Res. 21(1):1, (2019).
- Johmura Y, Maeda I, Suzuki N, Wu W, Goda A, Morita M, Yamaguchi K, Yamamoto M, Nagasawa S, Kojima Y, Tsugawa K, Inoue N, Miyoshi Y, Osako T, Akiyama F, Maruyama R, Inoue JI, Furukawa Y, Ohta T, Nakanishi M. Fbxo22-mediated KDM4B degradation determines selective estrogen receptor modulator activity in breast cancer. J Clin Invest. 128(12):5603-19, (2018).
- Yamamoto M, Sakane K, Tominaga K, Gotoh N, Niwa T, Kikuchi Y, Tada K, Goshima N, Semba K, Inoue JI. Intratumoral bidirectional transitions between epithelial and mesenchymal cells in triple-negative breast cancer. Cancer Sci. 108(6):1210-22, (2017).
- Ihara T, Hosokawa Y, Kumazawa K, Ishikawa K, Fujimoto J, Yamamoto M, Muramkami T, Goshima N, Ito E, Watanabe S, Semba K. An in vivo screening system to identify tumorigenic genes. Oncogene. 36(14):2023-9, (2017).
- Doi A, Ishikawa K, Shibata N, Ito E, Fujimoto J, Yamamoto M, Shiga H, Mochizuki H, Kawamura Y, Goshima N, Semba K, Watanabe S. Enhanced expression of retinoic acid receptor alpha (RARA) induces epithelial-to-mesenchymal transition and disruption of mammary acinar structures. Mol Oncol. 9(2):355-64, (2015).
- Ito-Kureha T, Koshikawa N, Yamamoto M, Semba K, Yamaguchi N, Yamamoto T, Seiki M, Inoue J. Tropomodulin 1 expression driven by NF-κB enhances breast cancer growth. Cancer Res. 75(1):62-72, (2015).
- Yamamoto M, Taguchi Y, Ito-Kureha T, Semba K, Yamaguchi N, Inoue J. NF-κB non-cell-autonomously regulates cancer stem cell populations in the basal-like breast cancer subtype. Nat Commun. 4:2299, (2013).
- Yamamoto M, Ito T, Shimizu T, Ishida T, Semba K, Watanabe S, Yamaguchi N, Inoue J. Epigenetic alteration of the NF-κB-inducing kinase (NIK) gene is involved in enhanced NIK expression in basal-like breast cancer. Cancer Sci. 101(11):2391-7, (2010).








