Aktの光操作を利用したインスリンシグナルのトランスオミックス解析
 研究代表者
研究代表者
小澤岳昌
東京大学大学院理学系研究科
http://www.chem.s.u-tokyo.ac.jp/users/analyt/
研究概要
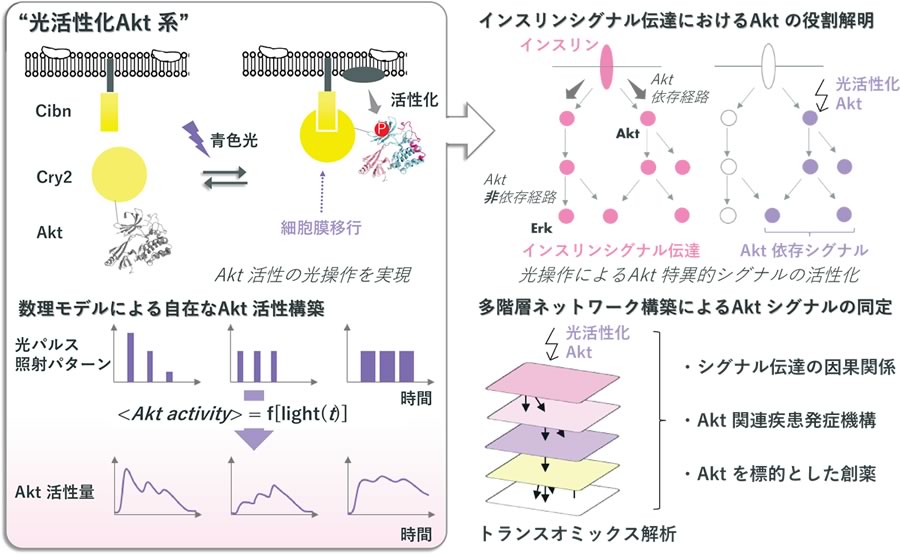
生命活動の基盤である生体内のシグナル伝達は遺伝子・タンパク質発現の制御, 転写・翻訳後修飾, 代謝反応など膨大な数の生化学反応により制御されている. シグナル伝達を制御する反応はDNA, RNA, タンパク質, 代謝物といった異なる特性を持った分子の集合から構成されているため, 細胞内シグナル伝達の統合的な理解には複数の分子種にまたがるデータ取得, および分子種間のネットワーク化が求められる. このような多階層に対する網羅的データ (オミックスデータ) からネットワークを再構築しシグナル伝達経路を理解するトランスオミックス解析のアプローチにより新たなシグナル伝達の動態が明らかにされた. しかしながら, シグナル伝達ネットワークを構成する分子間の因果関係を明らかにするためには特定のシグナル分子のみを特異的に制御した時のシグナル伝達ネットワークを解明する必要がある.
これまでに私たちは光を利用した細胞内特定酵素の操作ツールを開発してきた. これら光操作ツールの長所としては特定酵素の時空間活性が自在に制御可能であることが挙げられる. 特にキナーゼAktの特異的活性化法である“光活性化Akt系”では光パルス照射パターンとAktキナーゼ活性とを相関づける数理モデル(<Akt activity> =f[light(t)])を構築することで光操作による定量的なAkt活性制御が可能となった. シグナル伝達を担う分子の活性は様々な経時変化を伴うことが知られており, このような光照射パターンとキナーゼ活性の予測モデルを構築することで生理的な酵素活性パターンを模倣した摂動を細胞系に加えることが可能となる.
本研究課題ではこの光活性化Akt系を用いてAktを特異的に活性化した際の多階層オミックスネットワークを構築することでAktが関わるシグナル伝達の因果関係を明らかにすることを目指す. Aktはインスリンシグナル伝達経路の制御に重要な働きを持つことが示唆されているため, 私たちは特にインスリンシグナル伝達におけるAkt の役割に興味を持っている. 現在までに私たちはAkt依存的な多階層オミックスネットワーク構築に必要となる代謝物, 転写物を網羅的に解析した予備データを取得しているため, これらデータを用いて解析を進める. またインスリンシグナル伝達系ではキナーゼErkも重要な役割を果たす. そこで光活性化Akt系に加えてErk光操作ツールの光パルス照射パターンに対する活性予測数理モデルを構築し, 様々な時間パターンでAkt, Erkを活性化することで, Akt, Erk活性とインスリンシグナル伝達分子の活性との対応関係の解明を目指す.
参考文献:
- O. Takenouchi, H. Yoshimura, T. Ozawa. Unique Roles of β-Arrestin in GPCR Trafficking Revealed by Photoinducible Dimerizers. Sci. Rep., 8, 677 (2018).
- H. J. Bailes, N. Milosavljevic, L.-Y. Zhuang, E. J. Gerrard, T. Nishiguchi, T. Ozawa and R. J. Lucas. Optogenetic interrogation reveals separable G-protein dependent and independent signalling linking G-protein coupled receptors to the circadian oscillator. BMC Biology, 15, 40 (2017).
- M. Endo, M. Hattori, H. Toriyabe, H. Ohno, H. Kamiguchi, Y. Iino, T. Ozawa. Optogenetic activation of axon guidance receptors controls direction of neurite outgrowth. Sci. Rep., 6, 23976 (2016).
- Y. Katsura, H. Kubota, K. Kunida, A. Kanno, S. Kuroda, T. Ozawa. An optogenetic system for interrogating the temporal dynamics of Akt. Sci. Rep., 5, 14589 (2015).
- M. Hattori, S. Haga, H. Takakura, M. Ozaki and T. Ozawa. Sustained Accurate Recording of Intracellular Acidification in Living Tissues with a Photo-controllable Bioluminescent Protein. Proc. Nat. Acad. Sci. USA, 110, 9332-9337 (2013).








