動的構造平衡情報に基づく数理解析によるGPCRのシグナル制御機構の解明
 研究代表者
研究代表者
上田卓見
東京大学大学院薬学系研究科
http://ishimada.f.u-tokyo.ac.jp/public_html/
研究概要
G蛋白質共役型受容体 (GPCR) は、神経伝達、炎症反応、免疫応答といった多くの重要な生理機能を担う膜タンパク質である。GPCRを標的とする化合物は、現在市販されている薬の約1/3を占める。GPCRは、内在性リガンドや薬物の結合により活性化すると、細胞内のG蛋白質を活性化して、細胞内にcAMP濃度変化等のシグナルを誘起する (G蛋白質シグナル)。また、活性化されたGPCRが、GPCRキナーゼ (GRK) によりリン酸化された上で、アレスチンを活性化して、GPCRの内在化やERKの活性化等を誘起する経路も存在する (アレスチンシグナル)。
リガンドがGPCRを活性化する程度は薬効度と呼ばれており,GPCRリガンドの薬効度は以下のように異なることが知られている。GPCRはリガンド非存在下でも弱くシグナルを流すことが知られており、基礎活性と呼ばれている。基礎活性を阻害するリガンドは逆作動薬と呼ばれる。GPCRを完全に活性化するリガンドは完全作動薬と呼ばれ、弱くGPCRを活性化する部分作動薬が存在する。このような薬効度の違いは医療に活用されている。例えば、b2アドレナリン受容体 (b2AR) では、完全作動薬が急性の喘息に有効である一方、慢性的な治療では副作用の小さい部分作動薬が有効であることが報告されている。
また、G蛋白質とアレスチンの一方を選択的に活性化するGPCRリガンドが存在することが知られており、バイアスリガンドと呼ばれている。バイアスリガンドは理想的な作用を持つ薬物を開発する上で重要であると考えられている。例えば、m オピオイド受容体 (mOR) に結合して、G蛋白質シグナルを選択的に活性化する化合物が、G蛋白質シグナルとアレスチンシグナルを両方活性化するモルヒネよりも、副作用の少ない鎮痛薬となることが報告されている。
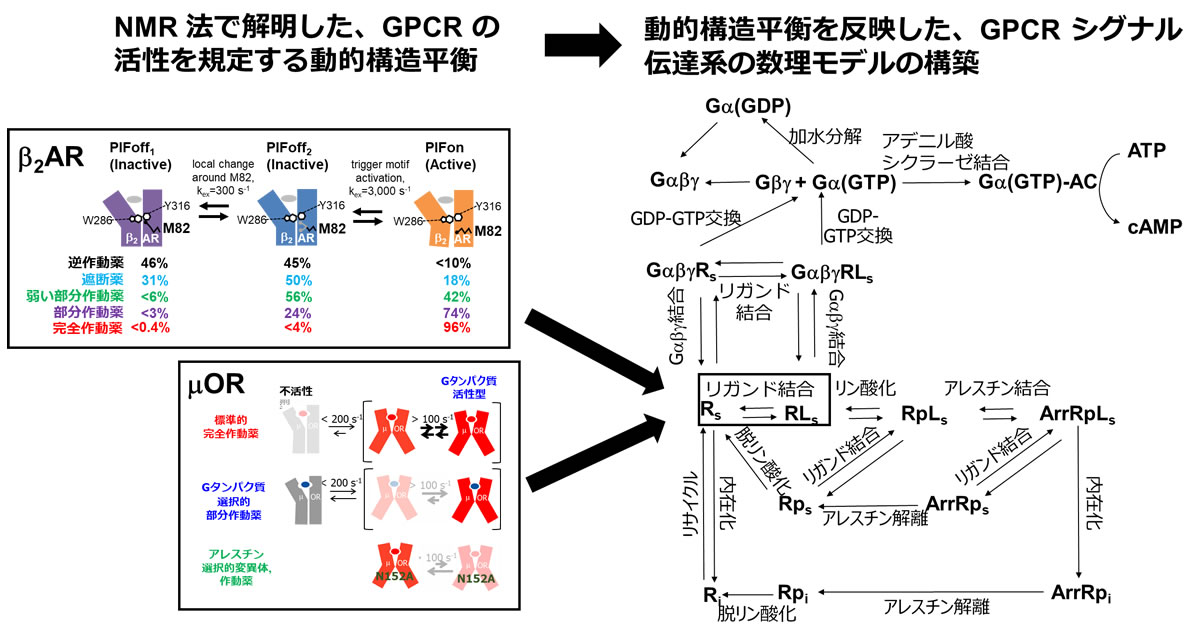
我々は、NMRを用いて、b2AR が活性型構造と不活性型構造の動的構造平衡状態にあること、および活性型構造の割合がリガンドの薬効度を規定することを明らかにした (Nature Commun. 2012, Angew. Chem. Int. Ed. 2014, Nat. Rev. Drug Discov. 2019)。さらに、mORが不活性型と複数の活性型の構造の平衡状態にあり、各活性型の割合がシグナル選択性を規定することを明らかにした(Angew. Chem. Int. Ed. 2015, Nat. Rev. Drug Discov. 2019)。また、NMRにより明らかにしたシグナル伝達系を構成する蛋白質の動的構造平衡を反映した数理モデルを構築することで、生理応答を再現する方法を開発した(Sci. Rep. 2017)。本研究課題では、上記の研究を展開して、mORおよび b2ARの薬効度やシグナル選択性を規定する動的構造平衡に基づいてG蛋白質シグナルおよびアレスチンシグナルの数理モデルを構築した上で、構築したモデルで各種リガンド添加に伴うcAMP濃度変化や内在化の実験値を再現することで、GPCRリガンドの薬効度やシグナル選択性が生じるメカニズムを解明する。
参考文献
- Shimada I, Ueda T, Kofuku Y, Eddy MT, and Wüthrich K., “GPCR drug discovery: integrating solution NMR data with crystal and cryo-EM structures” Nat. Rev. Drug Discov. (2019) 18, 59-82, doi: 10.1038/nrd.2018.180
- Shiraishi Y, Natsume M, Kofuku Y, Imai S, Nakata K, Mizukoshi T, Ueda T, Iwaï H, Shimada I., “Phosphorylation-induced conformation of b2-adrenoreceptor related to arrestin recruitment revealed by NMR”, Nat. Commun. (2018) 9, 194
- Minato Y, Ueda T, Machiyama A, Iwaï H, Shimada I., “Dynamic domain arrangement of CheA-CheY comprex regulates bacterial thermotaxis, as revealed by NMR”, Sci. Rep. (2017) 7, 16462
- Minato Y, Suzuki S, Hara T, Kofuku Y, Kasuya G, Fujiwara Y, Igarashi S, Suzuki E, Nureki O, Hattori M, Ueda T, Shimada I., “Conductance of P2X4 purinergic receptor is determined by conformational equilibrium in the transmembrane region”, Proc. Natl. Acad. Sci. (2016) 113,4741-4746
- Okude J., Ueda T., Kofuku Y., Sato M., Nobuyama N., Kondo K., Shiraishi Y., Mizumura T., Onishi K., Natsume M., Maeda M., Tsujishita H., Kuranaga T., Inoue M., and Shimada I., “Conformational equilibrium of m-opioid receptor determines its efficacies and functional selectivities”, Angew. Chem. Int. Ed. (2015) 53, 13376-13379
- Yoshiura C., Ueda T., Kofuku Y., Matsumoto M., Okude J., Kondo K., Shiraishi Y., and Shimada I., “Elucidation of the CCR1- and CCR5- binding modes of MIP-1a by application of an NMR spectra reconstruction method to the transferred cross-saturation experiments”, J. Biomol. NMR (2015) 63, 333-340
- Ueda T., Yoshiura C., Matsumoto M., Kofuku Y., Okude J., Kondo K., Shiraishi Y., Takeuchi K., and Shimada I., “Development of a method for reconstruction of crowded NMR spectra from undersampled time-domain data”, J. Biomol. NMR (2015) 62, 31-41
- Kofuku Y., Ueda T., Okude J., Shiraishi Y., Kondo K., Mizumura T., Suzuki S., and Shimada I., “Functional dynamics of deuterated β2 -adrenergic receptor in lipid bilayers revealed by NMR Spectroscopy”, Angew. Chem. Int. Ed.(2014) 53, 13376-13379
- Kofuku Y., Ueda T., Okude J., Shiraishi Y., Kondo K., Maeda M., Tsujishita H., Shimada I., “Efficacy of the b2-adrenergic receptor is determined by conformational equilibrium in the transmembrane region”, Nat. Commun. (2012) 3, 1045
- Ueda T., Nomoto N., Koga M., Ogasa H., Ogawa Y., Matsumoto M., Stampoulis P., Sode K., Terasawa H., and Shimada I., “Structural basis of efficient electron transport between photosynthetic membrane proteins and plastocyanin in spinach revealed using nuclear magnetic resonance”, Plant Cell(2012) 24, 4173-4186








