光制御と光計測によるシグナル伝達経路間の動的相互作用の解明
 研究代表者
研究代表者
磯村彰宏
京都大学 高等研究院 物質-細胞統合システム拠点(iCeMS)
http://www.icems.kyoto-u.ac.jp/ja/wwa/directory/#kageyama-j
研究概要
生体内のシグナル伝達ネットワークは、外部環境の動的変化に適応して恒常性維持を司る動的システムであり、その恒常性の破綻は多くの場合に病態や疾患を伴う。近年、蛍光タンパク質を初めとするイメージング技術の発展によって、細胞増殖 (MAPK-ERK) 、発生・分化(Hes1/7)、 DNA 修復(p53)、免疫応答(NF-κB)、などの生命現象でシグナル活性の動的パターンが発見された。しかし、特定の生体分子活性の動的パターンが本当に様々な生命現象を誘導できるのか、病態や疾患の原因となりうるのか、といった因果関係は明らかではなかった。
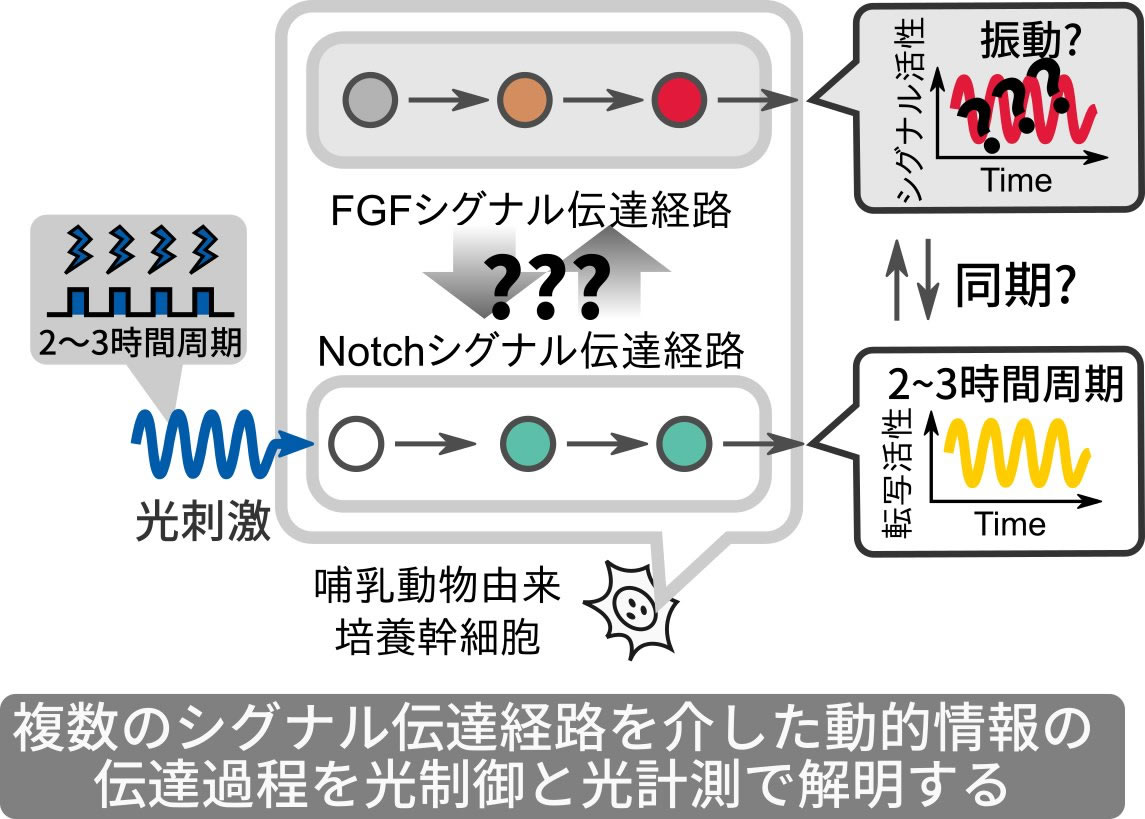
それに対し、我々は青色光応答性タンパク質を基盤とした転写発現の光制御技術を活用して、哺乳動物細胞内における転写因子やリガンドタンパク質の発現ダイナミクス(個数の増減)による細胞機能の制御機構を解明してきた(参考文献3,5)。最近では、任意のタンパク質の発現を2〜3時間周期の短時間スケールで光誘導しつつ細胞応答を発光タンパク質によって計測する技術を確立した。これを応用して、Notchシグナル伝達経路におけるリガンドタンパク質Deltaを送信細胞内で2〜3時間周期で発現させ、隣接する受信細胞の周期的な応答を発光計測によってリアルタイム観察し、Deltaが遺伝子発現活性の動的情報を細胞間伝達において媒介できる生体分子であることを構成的に明らかにした(参考文献3)。また、MAPKシグナル伝達経路においては、SOSやRafの光操作技術を使った研究が国内外から報告され(Aoki et al. (2013)., Toettcher et al. (2013)., Bugaj et al. (2018).)、ERK活性ダイナミクスがヒト癌細胞の増殖を制御できることが明らかになった。このように、様々なシグナル伝達経路における動的制御様式が光遺伝学と生細胞イメージングの融合技術によって明らかとなりつつある。しかし、同一の細胞内で異なるシグナル伝達経路の動的パターンがどのように共存しているのか、主従関係や協調関係が存在するのかは十分に明らかでない。
そこで本研究では、 発生過程の一過的な組織である未分節中胚葉における、FGFおよびNotchシグナルの動的パターンの共存に着目した研究を行う。具体的には、片方のシグナル活性を青色光制御しながら両方のシグナル活性の細胞応答を同時に生細胞イメージングするための融合的基盤技術を確立する(図)。そして、FGF/Notchシグナル間の動的パターンの統合・情報処理機構を解明し、シグナル伝達ネットワークの動的制御様式の包括的理解に貢献することを目指す。
参考文献
- “ES cell-derived presomitic mesoderm-like tissues for analysis of synchronized oscillations in the segmentation clock”, M. Matsumiya, T. Tomita, K. Y.-Kobayashi, A. Isomura, R. Kageyama, Development 145, dev156836 (2018).
- “Illuminating information transfer in signaling dynamics by optogenetics”, A. Isomura, R. Kageyama, Curr. Opin. Cell Biol. 49, 9-15 (2017).
- “Optogenetic perturbation and bioluminescence imaging to analyze cell-to-cell transfer of oscillatory information”, A. Isomura, and F. Ogushi, H. Kori and R. Kageyama Genes. Dev. 31, 524-535 (2017). (highlighted in Nat. Chem. Biol. 13, 569 (2017).)
- “Ultradian oscillations and pulses: coordinating cellular responses and cell fate decisions”, A. Isomura and R. Kageyama, Development 141, 3627-3636 (2014).
- “Oscillatory control of factors determining multipotency and fate in mouse neural progenitors”, I. Imayoshi‡, A. Isomura‡, Y. Harima, K. Kawaguchi, H. Kori, H. Miyachi, T. K. Fujiwara, F. Ishidate, and R. Kageyama, Science 342, 1203-1208 (2013). (‡ Equal contribution)








