GPCR細胞内シグナル伝達の立体構造に基づく定量的解析
 研究代表者
研究代表者
幸福裕
東京大学 大学院薬学系研究科 生命物理化学教室
http://ishimada.f.u-tokyo.ac.jp/public_html/index_j.html
研究概要
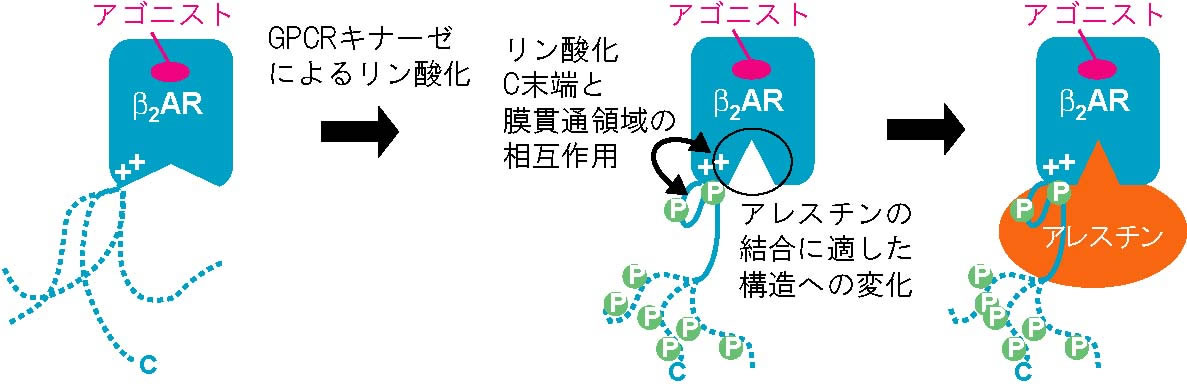
近年、Gタンパク質共役型受容体 (GPCR) に結合して特定のシグナル伝達経路を選択的に活性化するリガンドが、副作用の少ない医薬品候補として注目されるなど、GPCRのシグナル伝達研究の重要性は増している。GPCRには、Gタンパク質、GPCRキナーゼ、アレスチンなど複数の細胞内因子が結合し、また、その活性はGタンパク質のリン酸化により変化する。このようなGPCRシグナル伝達の複雑性から、その定量的な理解は現時点で困難である。申請者は、GPCRを含めた膜タンパク質の動的構造がシグナル伝達を制御する機構を解明してきた (Nature Commun 2012, Angew Chem Int Ed 2014, Angew Chem Int Ed 2015, PNAS 2016)。また、最近、GPCRのリン酸化およびGPCRとシグナル伝達分子の結合がGPCRの動的構造に影響を与えることを初めて見出した (Nature Commun 2018)。このことは、複数の細胞内因子やリン酸化により制御される、GPCRシグナル伝達を定量的に理解する上で、その動的構造に関する情報が不可欠であることを示している。本研究では、GPCRの一種であるβ2アドレナリン受容体 (β2AR) について、GPCRキナーゼによるリン酸化、およびアレスチンを介したシグナル伝達が生じる機構を、動的構造に基づいて解明し、GPCRのシグナル伝達の定量的な記述を可能にする。
参考文献
- Shimada I, Ueda T, Kofuku Y, Eddy MT, Wüthrich K. GPCR drug discovery: integrating solution NMR data with crystal and cryo‑EM structures. Nature Reviews Drug Discovery (2019) 18, 59-82
- Shiraishi Y, Natsume M, Kofuku Y, Imai S, Nakata K, Mizukoshi T, Ueda T, Iwaï H, Shimada I. Phosphorylation-induced conformation of β2-adrenoceptor related to arrestin recruitment revealed by NMR. Nature Commun (2018) 9, 194
- Minato Y, Suzuki S, Hara T, Kofuku Y, Kasuya G, Fujiwara Y, Igarashi S, Suzuki E, Nureki O, Hattori M, Ueda T, Shimada I. Conductance of P2X4 purinergic receptor is determined by conformational equilibrium in the transmembrane region. Proc Natl Acad Sci USA (2016) 113, 4741-4746
- Okude J, Ueda T, Kofuku Y, Sato M, Nobuyama N, Kondo K, Shiraishi Y, Mizumura T, Onishi K, Natsume M, Maeda M, Tsujishita H, Kuranaga T, Inoue M, Shimada I. Identification of a Conformational Equilibrium That Determines the Efficacy and Functional Selectivity of the μ-Opioid Receptor. Angew Chem Int Ed (2015) 54, 15771-15776
- Kofuku Y, Ueda T, Okude J, Shiraishi Y, Kondo K, Mizumura T, Suzuki S, Shimada I. Functional dynamics of deuterated β2-adrenergic receptor in lipid bilayers revealed by NMR spectroscopy. Angew Chem Int Ed (2014) 53, 13376-13379
- Kofuku Y, Ueda T, Okude J, Shiraishi Y, Kondo K, Maeda M, Tsujishita H, Shimada I. Efficacy of the β2-adrenergic receptor is determined by conformational equilibrium in the transmembrane region. Nature Commun (2012) 3, 1045
- Yoshiura C, Kofuku Y, Ueda T, Mase Y, Yokogawa M, Osawa M, Terashima Y, Matsushima K, Shimada I. NMR analyses of the interaction between CCR5 and its ligand using functional reconstitution of CCR5 in lipid bilayers. J Am Chem Soc (2010) 132, 6768-6777
- Kofuku Y, Yoshiura C, Ueda T, Terasawa H, Hirai T, Tominaga S, Hirose M, Maeda Y, Takahashi H, Terashima Y, Matsushima K, Shimada I. Structural basis of the interaction between chemokine stromal cell-derived factor-1/CXCL12 and its G-protein-coupled receptor CXCR4. J Biol Chem (2009) 284, 35240-35250








