出芽酵母リン酸化酵素TDA1の糖シグナル伝達における役割の解明
 研究代表者
研究代表者
嘉村巧
名古屋大学大学院理学研究科
http://bunshi4.bio.nagoya-u.ac.jp/~2kamura/
研究概要
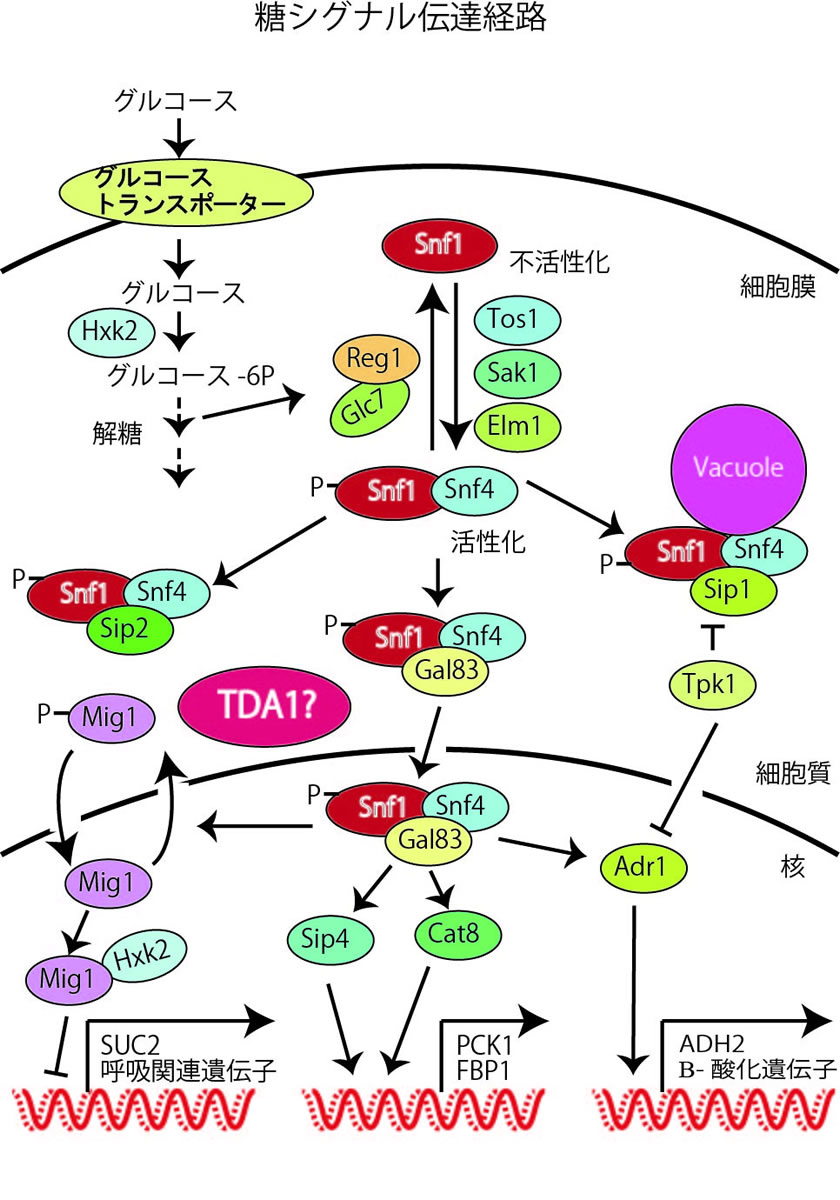
細胞内エネルギーの恒常性を維持することは正常な生命活動を行う上で重要であるが、その中心的な役割を担っているのは、哺乳類ではAMP(5’AMP-activated protein kinase)キナーゼであり、このキナーゼは真核生物において高度に保存されている。出芽酵母においては、Snf1(Sucrose nonfermenting 1)、Snf4およびGal83/Sip1/Sip2からなる複合体がエネルギー状態のセンサーとして機能しており、この中でSnf1がキナーゼドメインを有し活性に必須な分子である。出芽酵母を高濃度のグルコース存在下で培養すると、主に発酵によってATPが作られる。一方、グルコース濃度が低下した場合や、酢酸やグリセロールのような非発酵性の炭素源で培養した場合は、エネルギーを発酵ではなく酸化的リン酸化によって作り出すようになる。この切り替えは主に遺伝子発現のオン・オフによって制御されている。豊富なグルコース存在下では、エネルギー代謝にかかわる一連の遺伝子発現は著明に抑制されているが(グルコース抑制と呼ばれる)、低グルコース環境下あるいは非発酵性の炭素源存在下では、この抑制が解除され、効率的に酸化的リン酸化が行われるようになる。この切り替えスイッチの役割を担っているのがSnf1である。Snf1は低グルコース環境を感知するとTos1、Sak1、Elm1により210番目のスレオニンがリン酸化を受け活性化され、様々な下流経路を活性化し、結果として低グルコース環境に適応できるようになる。
われわれは、ユビキチンープロテアソーム依存性タンパク質分解により制御される生命現象の解明を目的の研究を進めており、出芽酵母SCFUcc1 E3リガーゼや哺乳類CRL5ASB7 およびCRL5SPSB4 E3リガーゼの新規機能を発見し報告している。われわれは、最近出芽酵母の短寿命タンパク質の分解に関与するE3の同定を進めているが、その過程で、キナーゼタンパク質Tda1の分解を制御するE3を新たに同定した。Tda1は機能未知のキナーゼであったが、最近出芽酵母に3種類存在するヘキソキナーゼの1つであるHxk2の15番目のセリンをリン酸化することが報告され、Tda1の糖シグナルへの関与が示唆された。Hxk2は非常に興味深い分子であり、細胞質でのヘキソキナーゼとしての機能に加えて核内においてグルコース抑制遺伝子群の転写制御にも関与していること、さらにHxk2の核内外の局在変化は15番目のセリンのリン酸化状態によることが明らかにされているが、一方ではSnf1がHxk2の15番目のセリンをリン酸化し、Hxk2の核内外の局在変化にTda1が関係しないことも示されており、Tda1の機能には不明な点が多く残されている。われわれは予備的実験により非発酵性炭素源環境下でTda1が速やかにリン酸化修飾を受けることおよびtda1欠失株で糖シグナル経路によって発現が制御されている遺伝子群の発現量が変化することを見出しており、Tda1が糖シグナル経路に関与していることが示唆された。そこで本課題では、Tda1のユビキチンープロテアソーム系による分解制御および糖シグナル伝達における役割に焦点を当てて研究を行う。さらには班員との共同研究で数理解析を用いて、糖シグナル伝達による遺伝子発現パターンをシュミレーションする。
参考文献
- Okumura, F., Joo-Okumura, A., Obara, K., Petersen, A., Nishikimi, A., Fukui, Y., Nakatsukasa, K., and Kamura, T. Ubiquitin ligase SPSB4 diminishes cell repulsive responses mediated by EphB2. Mol Biol Cell 28(24):3532-3541. doi: 10.1091/mbc.E17-07-0450. (2017)
- Okumura, F., Joo-Okumura, A., Nakatsukasa, K., and Kamura, T. Hypoxia-inducible factor-2α stabilizes the von Hippel-Lindau (VHL) disease suppressor, Myb-related protein 2. PLos One 12(4):e0175593. doi: 10.1371/journal.pone.0175593. (2017)
- Uematsu, K., Okumura, F., Tonogai, S., Okumura, AJ., Alemayehu, DH., Nishikimi, A., Fukui, Y., Nakatsukasa, K., and Kamura, T. ASB7 regulates spindle dynamics and genome integrity by targeting DDA3 for proteasomal degradation. J Cell Biol215(1):95-106. DOI: 10.1083/jcb.201603062. (2016)
- Okumura, F., Uematsu, K., Byrne, SD., Hirano, M., Joo-Okumura, A., Nishikimi, A., Shuin. T., Fukui, Y., Nakatsukasa, K., Kamura, T. Parallel regulation of VHL disease by pVHL-mediated degradation of B-Myb and HIF-α. Mol Cell Biol 36(12):1803-17. doi: 10.1128/MCB.00067-16. (2016)
- Nakatsukasa, K., Kamura, T. Subcellular Fractionation Analysis of the Extraction of Ubiquitinated Polytopic Membrane Substrate during ER-Associated Degradation. PLoS One 11(2):e0148327. doi: 10.1371/journal.pone.0148327. (2016)
- Nakatsukasa, K., Nishimura, T., Byrne, D., Okamoto, M., Takahashi-Nakaguchi, A., Chibana, H., Okumura, F., Kamura, T. The ubiquitin ligase SCFUcc1 acts as a metabolic switch for the glyoxylate cycle. Molecular Cell 59:22-34 doi: 10.1016/j.molcel.2015.04.013. (2015)








