神経筋伝達を担うアセチルコリン受容体の発現制御シグナルの解明
 研究代表者
研究代表者
山梨裕司
東京大学・医科学研究所・教授
http://www.ims.u-tokyo.ac.jp/genetics/html/home.html
研究概要
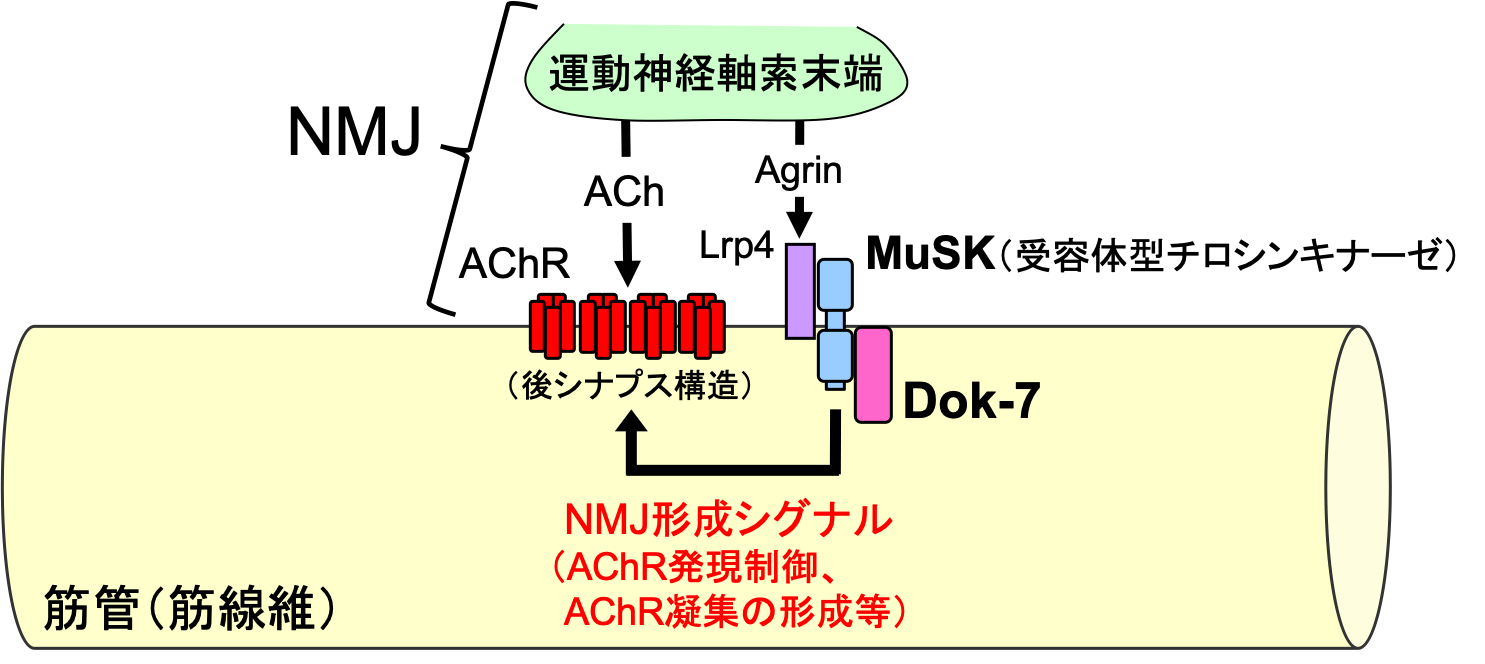
神経筋シナプスは神経筋接合部(NMJ:Neuromuscular Junction)とも呼ばれ、運動神経の軸索末端と筋管(筋繊維)中央部の後シナプス構造を連結し、呼吸・運動機能を担う骨格筋収縮の運動神経支配に必須の役割を担っている。哺乳動物のNMJはアセチルコリン(ACh)を伝達物質とするシナプスであり、その効率的な機能には筋管でのACh受容体(AChR)の発現と後シナプス部位での高密度の凝集が必要である。AChRの発現誘導を含む後シナプス構造の形成は筋特異的な受容体型チロシンキナーゼMuSKによって制御されており、その活性化は共受容体であるLrp4を介して運動神経由来のAgrinによって誘導される(図)。しかしながら、研究代表者らは独自に単離した骨格筋内のアダプター様分子Dok-7がMuSKの細胞内領域に直接作用し、活性化することがMuSK依存的なAChRの発現誘導や後シナプス構造の形成、ひいてはNMJの形成に必須であることを発見した。また、筋管特異的にDok-7を高発現するトランスジェニック(Dok-7 Tg)マウスを作出し、その発現が筋管でのMuSK活性化を増強し、前シナプスを含めたNMJ全体を拡張することも明らかにしている。さらに、ヒトDOK7の遺伝性疾患としてDOK7型筋無力症を発見し、それがDok-7のMuSK活性化能の減弱によるNMJ形成不全疾患であることを解明すると共に、Lrp4に対する自己抗体陽性の重症筋無力症(NMJの自己免疫疾患)を発見した。
一方、近年の研究からNMJの形成不全が、NMJの異常を直接の病因とする筋無力症だけでなく、筋ジストロフィー(MD)や筋萎縮性側索硬化症(ALS)などにも認められることが判明した。そこで、代表者はNMJ形成不全に起因する運動機能障害(筋力低下)はNMJ形成シグナルの増強によって改善できるという対症療法の可能性に思い至った。事実、アデノ随伴ウイルス(AAV)を用いたDok-7発現ベクター(AAV-D7)の発症後の投与が、DOK7型筋無力症やMD、ALSのモデルマウスのNMJを拡張することで、運動機能の改善と延命効果をもたらすことを実証している。
しかしながら、MuSKを起点とする筋管細胞内のNMJ形成シグナルは未解明である(図)。そこで、本研究においてはNMJ形成シグナルのうち、特にAChR発現制御シグナルに焦点を当て、代表者らが単離した新規シグナル分子を中核とするシグナル経路の数理解析を推進し、AChR発現制御シグナルの全体像の理解を目指す。
参考文献
- Miyoshi, S., Tezuka, T., Arimura, S., Tomono, T., Okada, T., and Yamanashi, Y. DOK7 gene therapy enhances motor activity and life span in ALS model mice. EMBO Mol. Med. 9: 880-889 (2017)
- Eguchi, T., Tezuka, T., Miyoshi, S., and Yamanashi, Y. Postnatal knockdown of dok-7 gene expression in mice causes structural defects in neuromuscular synapses and myasthenic pathology. Genes Cells 21: 670-676 (2016)
- Tezuka, T., Inoue, A., Hoshi T., Weatherbee, S.D., Burgess, R.W., Ueta, R., and Yamanashi, Y. The MuSK actvator agrin has a separate role essential for a postnatal maintenance of neuromuscular synapses. Proc. Natl. Acad. Sci. USA. 111, 16556-16561 (2014)
- Arimura, S., Okada, T., Tezuka, T., Chiyo, T., Kasahara, Y., Yoshimura, T., Motomura, M., Yoshida, N., Beeson, D., Takeda, S., and Yamanashi, Y. DOK7 gene therapy benefits mouse models of diseases characterized by defects in the neuromuscular junction. Science 345: 1505-1508 (2014)
- Hoshi, T., Tezuka, T., Yokoyama, K., Iemura, S., Natsume, T., and Yamanashi, Y. Mesdc2 plays a key role in cell-surface expression of Lrp4 and postsynaptic specialization in myotubes. FEBS Lett. 587: 3749-3754 (2013)
- Higuchi, O., Hamuro J., Motomura, M. and Yamanashi, Y. Autoantibodies to LDL receptor-related protein 4 in myasthenia gravis. Annals of Neurology 69: 418-422 (2011)
- Inoue, A., Setoguchi, K., Matsubara, Y., Okada, K., Sato, N., Iwakura, Y., Higuchi, O., and Yamanashi, Y. Dok-7 activates the muscle receptor kinase MuSK and shapes synapse formation. Science Signaling 2: ra7 (2009)
- Hamuro J, Higuchi O, Okada K, Ueno M, Iemura S, Natsume T, Spearman H, Beeson D, & Yamanashi Y. Mutations causing DOK7 congenital myasthenia ablate functional motifs in Dok-7. J. Biol. Chem. 283: 5518-5524 (2008)
- Beeson D, Higuchi O, Palace J, Cossins J, Spearman H, Maxwell S, Newsom-Davis J, Burke G, Fawcett P, Motomura M, Muller J, Lochmuller H, Slater C, Vincent A, & Yamanashi Y. Dok-7 mutations underlie a neuromuscular junction synaptopathy. Science 313: 1975-1978 (2006)
- Okada K, Inoue A, Okada M, Murata Y, Kakuta S, Jigami T, Kubo S, Shiraishi H, Eguchi K, Motomura M, Akiyama T, Iwakura Y, Higuchi O, & Yamanashi Y. The muscle protein Dok-7 is essential for neuromuscular synaptogenesis. Science 312: 1802-1805 (2006)








