ユビキチン化による炎症・免疫シグナルの時空間制御とその数理シミュレーション
 研究代表者
研究代表者
井上純一郎
東京大学医科学研究所 分子発癌分野
http://www.traf6.com
研究概要
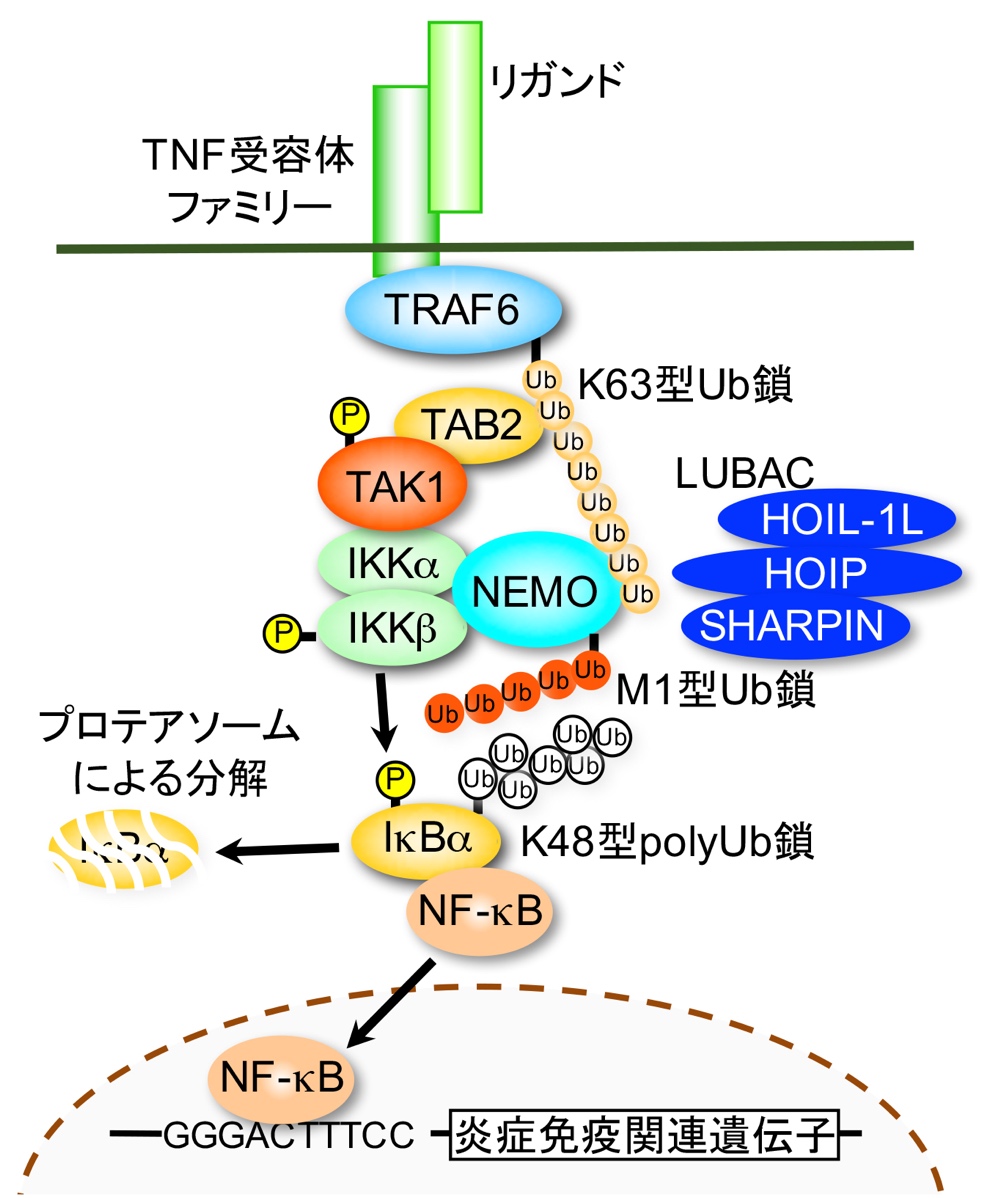
転写因子NF-κBは、通常その抑制因子IκBと複合体を形成することにより細胞質に係留され不活化されているが、細胞外シグナルによりIκBのリン酸化とそれに続くLys48型ポリユビキチン化によりIκBがプロテアソーム依存的に分解され、NF-κBが核移行し活性化される。この時IκBをリン酸化するIκB kinase複合体(IKKα, IKKβ, NEMOで構成)の活性化には、タンパク質のLys63型ポリユビキチン化を介したシグナル複合体形成が必要であると考えられている。Lys63型ポリユビキチン鎖はタンパク質分解を誘導せず、このユビキチン鎖に結合するタンパク質群を介してシグナル複合体形成の足場となると考えられている。さらに、分担研究者の徳永らは、NEMOのMet1型(直鎖状)ポリユビキチン化がNF-κB活性化に関与することを明らかにしている。即ち、NF-κB活性化シグナルは、3つの異なるユビキチン化反応によって制御されており、シグナル伝達の翻訳後修飾による制御という観点からも、注目を集めている(図)。
我々は、このLys63型ユビキチン化を触媒するE3ユビキチン連結酵素TRAF6を発見し、さらに、TRAF6欠損マウスの解析から、TRAF6によるNF-κB活性化の異常がリウマチや骨粗鬆症に関与する骨代謝異常、自然免疫異常、自己免疫疾患、汗腺や毛包の発生異常を伴う無汗性外胚葉形成不全症を発症させることを示した。また、発癌にもTRAF6が関与することが報告されている。またこれまでにNF-κBの標準的経路によるNF-κBの核内濃度の振動の3Dシミュレーションに成功するともに、非標準的経路における振動を世界で初めて可視化することにも成功し、NF-κBシグナル研究において数理シミュレーションを導入可能な生命現象をさらに見出している。このような背景と準備状況を鑑み、以下の計画を数理シグナル領域の他班と密に連携して研究分担者の徳永とともに推進する。
| 1) | 非標準的経路におけるNF-κBの核内濃度振動のメカニズム解明とその数理シミュレーション:非標準的経路におけるNF-κBの核内濃度振動と転写との関係を明らかにする。 |
| 2) | in vivoに近い極性をもったNF-κBシグナルのイメージングとその数理シミュレーション:上野との連携でケミカルを用いて細胞局所で極性を持ったNF-κBシグナルを任意の時間に活性化する系を確立し、IκBαの分解とNF-κBの核移行を可視化することでシグナル伝播を解析する |
| 3) | 上記1)と2)については各実験系からダイナミクスに関するデータを取得し鈴木及び久保田と連携してその分子機構を数理シミュレーションによって解析する。 |
| 4) | Lys63型ポリユビキチン鎖とMet1型(直鎖状)ポリユビキチン鎖によるNF-κBシグナル制御に関与する新規因子の同定、その作用機構の解析と免疫炎症反応における生理的意義の解明:澤崎のプロテインアレイおよび尾山のタンパク質複合体の質量分析と連携してUb鎖を介するNF-κB制御に関与する新規因子を同定し、その機能および作用機構解明を培養細胞やマウス個体を用いて実施する。 |
| 5) | 前項3)で同定したタンパク質の単独あるいは複合体の立体構造解析:石谷と連携して実施し、その結果をもとにタンパク質の作用機構を解明する。 |
| 6) | Lys63型ポリユビキチン鎖によるNF-κBシグナルの阻害剤及びバイオプローブ探索:前項4)で同定したタンパク質に特異的に結合する阻害剤やバイオプローブとして機能する化合物を澤崎と上野と連携して探索する。 |
参考文献
- Ito-Kureha, T., Koshikawa, N., Yamamoto, M., Semba, K., Yamaguchi, N., Yamamoto, T., Seiki, M. and Inoue, J.* Tropomodulin 1 expression driven by NF-κB enhances breast cancer growth. Cancer Res. 75, 62–72 (2015).
- Yamamoto, M., Taguchi, Y., Ito-Kureha, T., Semba, K., Yamaguchi, N. and Inoue J. NF-κB non-cell-autonomously regulates cancer stem cell populations in the basal-like breast cancer subtype. Nat. Commun. 4:2299 doi: 10.1038/ncomms3299 (2013).
- Shibata, Y., Oyama, M., Kozuka-Hata, H., Han, X., Tanaka, Y., Gohda, J. and Inoue, J. p47 negatively regulates IKK activation by inducing the lysosomal degradation of polyubiquitinated NEMO. Nat. Commun. 3:1061 doi:10.1038/ncomms2068 (2012).
- Yamazaki, K., Gohda, J., Kanayama, A., Miyamoto, Y., Sakurai, H., Yamamoto, M., Akira, S., Hayashi, H., Su, B., and Inoue, J. Two Mechanistically and Temporally Distinct NF-κB Activation Pathways in IL-1 Signaling. Sci. Signal. 2, ra66 (2009).
- Akiyama T., Shimo Y., Yanai H., Qin J., Ohsima, D., Maruyama Y., Asaumi Y., Kitazawa J., Takayanagi H., Penninger JM., Matsumoto M., Nitta T., Takahama Y., and Inoue J. The Tumor Necrosis Factor family receptors RANK and CD40 cooperatively establish the thymic medullary microenvironment and self-tolerance. Immunity 29, 423-437 (2008).
- Akiyama, T., Maeda, S., Yamane, S., Ogino, K., Kasai, M., Kajiura, F., Matsumoto, M., and Inoue, J. Dependence of Self-tolerance on TRAF6-directed Development of Thymic Stroma. Science 308 (5719), 248-251 (2005).
- Gohda, J., Akiyama, T., Koga, T., Takayanagi, H., Tanaka, S., and Inoue, J. RANK-mediated amplification of TRAF6 signaling leads to NFATc1 induction during osteoclastogenesis. EMBO J 24, 790-799 (2005).
- Kobayashi N., Kadono Y., Naito A., Matsumoto K., Yamamoto T., Tanaka S., and Inoue J. Segregation of TRAF6-mediated signaling pathways clarifies its role in osteoclastogenesis EMBO J. 20, 1271-1280 (2001).
- Inoue, J., Kerr, L.D., Kakizuka, A. and Verma, I.M. IκBγ, a 70kd protein, identical to the C terminal half of p110 NFκB: a new member of the IκB family. Cell 68, 1109-1120 (1992).








