相分離を介したシグナル伝達制御の構造基盤
 研究代表者
研究代表者
齋尾智英
北海道大学 理学研究院
https://wwwchem.sci.hokudai.ac.jp/~stchem/
研究概要
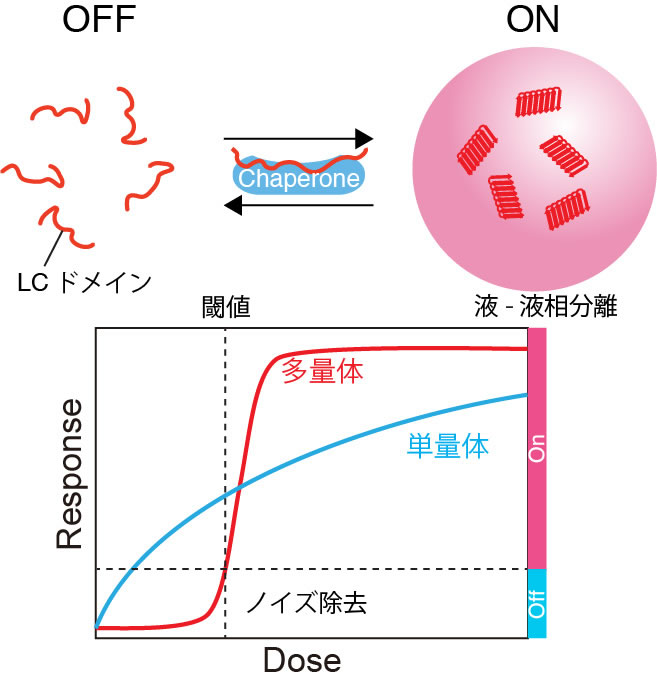
これまでの多くのシグナル伝達研究においては,特定のタンパク質間の1:1相互作用における特異性の高いクロストークが注目されてきたが,この数年間で流動的な多量体形成によって支配されるシグナル伝達の重要性が認識されつつある.高次構造を持ったタンパク質間の相互作用は,生体内で起こっている多様なイベントの中の一部にすぎないことが明らかになってきた.特に最近は,ゆるく動的な相互作用による多量体によって形成される液-液相分離を伴ったシグナル伝達制御が注目を集めている.液-液相分離を形成する分子には,low-complexity (LC) ドメインと呼ばれるアミノ酸組成が著しく偏った領域を持つものが多いが,LCドメインは高次構造を取らず柔軟な状態として存在し,アミロイド様cross-βポリマーを形成することによって多量体化し,相分離する.最近の研究によって,LCドメインの多量体化がシャペロンによって制御されることが明らかにされているが,その詳細なメカニズムはほとんど明らかにされていない.このような,複数分子の集合的挙動によって支配されるシグナル伝達機構制御のメカニズム解明のためには,数理解析を含めたアプローチが効果的であると考えられるが,現状では数理解析の基盤となる実験データが不足している.
そこで本研究では,LCドメインの多量体形成と液-液相分離によるシグナル伝達制御機構を実験的に解き明かす.具体的には,NMRによる相互作用解析や立体構造解析によって,シャペロンによるLCドメインの制御メカニズムについての分子基盤・構造基盤を整備する.さらに,領域内連携によって数理解析も積極的に取り入れ,実験データを統合する.
参考文献
- *Saio, T. , Ishimori, K. Accelerating structural life science by paramagnetic lanthanide probe methods. (2019) Biochim. Biophys. Acta. Gen. Subj. in press.
- *Okumura, M., Noi, K., Kanemura, S., Kinoshita, M., Saio, T., Inoue, Y., Hikima, T., Akiyama, S., *Ogura, T., *Inaba, K. Dynamic assembly of protein disulfide isomerase in catalysis of oxidative folding. (2019) Nat. Chem. Biol. 15, 499-509.
- Kawagoe, S., Nakagawa, H., Kumeta, H., Ishimori, K., *Saio, T. Structural insight into proline cis/trans isomerization of unfolded proteins catalyzed by the trigger factor chaperone. J. Biol. Chem. (2018) 293, 15905-15106.
- *Saio, T., Kawagoe, S., Ishimori, K., *Kalodimos, C.G. Oligomerization of a molecular chaperone modulates its activity. eLife (2018) 7, e35731.
- Sato, W., Uchida, T., Saio, T., *Ishimori K. Polyethylene glycol promotes autoxidation of cytochrome c. Biochim. Biophys. Acta. Gen. Subj. (2018) 1862, 1339-1349
- Huang, C., Rossi, P., Saio, T., *Kalodimos, C.G. Structural basis for the antifolding activity of a molecular chaperone. Nature (2016) 537, 202-206.
- Imai, M., Saio, T., Kumeta, H., Uchida, T., Inagaki, F., Ishimori, K. Investigation of the redox-dependent modulation of structure and dynamics in human cytochrome c. Biochem. Biophys. Res. Commun. (2016) 469, 978-84.
- Monneau, Y.R., Ishida, Y., Rossi, P., Saio, T., Tzeng, S.R., Inouye, M., *Kalodimos, C.G. Exploiting E. coli auxotrophs for leucine, valine, and threonine specific methyl labeling of large proteins for NMR applications. J. Biomol. NMR (2016) 65, 99-108.
- Saio, T., Ogura, K., Kumeta, H., Kobashigawa, Y., Shimizu, K., Yokochi, M., Kodama, K., Yamaguchi, H., Tsujishita, H., *Inagaki, F. Ligand-driven conformational changes of MurD visualized by paramagnetic NMR. Sci. Rep. (2015) 5, 16685.
- Saio, T., Guan, X., Rossi, P., Economou, A., *Kalodimos, CG. Structural basis for protein anti-aggregation activity of the trigger factor chaperone. Science (2014) 344, 1250494.








