自然免疫分子STINGを介したシグナル伝達経路の重層的プロテオーム解析
 研究代表者
研究代表者
小迫英尊
徳島大学 先端酵素学研究所 藤井節郎記念医科学センター
http://www.fujii.tokushima-u.ac.jp/cellsignaling/
研究概要
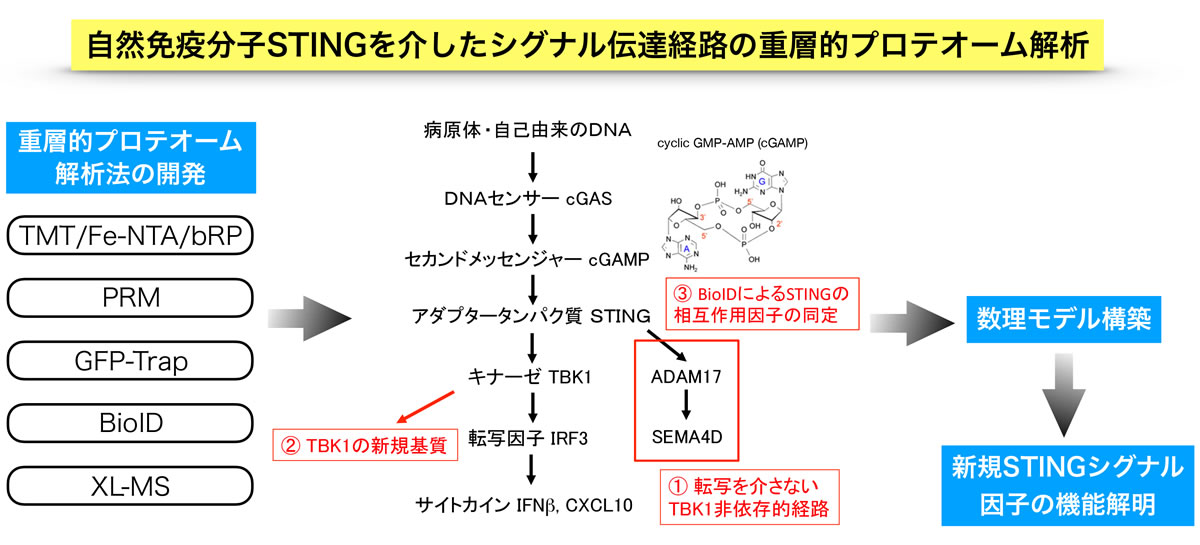
STING (stimulator of interferon genes)は、病原体や自己由来の細胞質DNAに応答して、インターフェロン産生や炎症などの自然免疫系を活性化する4回膜貫通タンパク質であり、そのシグナル経路の概要が最近明らかになった。即ち、DNAを認識したcGASによってcGAMP (cyclic GMP-AMP)が産生され、cGAMPと結合したSTINGは小胞体からゴルジ体に移行してTBK1キナーゼを活性化し、TBK1によってリン酸化されたIRF3がサイトカインを誘導する。しかし従来の生化学・分子生物学を基盤とする研究からは、その全体像を理解する上で十分な知見が得られていない。特にSTINGの下流因子や相互作用因子を網羅的に同定するためには、プロテオミクス技術の更なる進展が必須である。
本研究では、研究代表者が運用する4台の高性能質量分析計を駆使して、最新の各種プロテオミクス技術を融合・発展させた以下の5層から成る重層的な精密定量プロテオーム解析法を開発する。
1)TMT (tandem mass tag)法と濃縮・分画技術を組み合わせた大規模比較定量法
2)PRM (parallel reaction monitoring)に基づくターゲット質量分析による精密定量法
3)GFP-Trap(固定化GFP結合nanobody)を用いた免疫沈降による相互作用因子の同定・定量
4)BioID法(近位依存性ビオチン標識法)による相互作用因子の同定・定量
5)XL-MS (cross-linking coupled with MS)によるタンパク質間相互作用部位の同定・定量
そしてSTINGを介した自然免疫シグナル経路の全体像とその制御機構を明らかにする。得られた大規模な定量データを本領域内の数理解析を専門とする研究者に提供し、自然免疫応答のシミュレーション構築を目指す。核やミトコンドリアから細胞質に漏出したDNAがSTINGを活性化することで老化・がん化やパーキンソン病とも関連することが明らかになってきており、本研究によって未知のSTINGシグナル因子の生理・病理機能が明らかになれば、これらの疾患に対する新たな治療戦略に繋がることが期待される。
参考文献
- Takashi Y, Kosako H, Sawatsubashi S, Kinoshita Y, Ito N, Tsoumpra M, Nangaku M, Abe M, Matsuhisa M, Kato S, Matsumoto T, Fukumoto S. Activation of unliganded FGF receptor by extracellular phosphate potentiates proteolytic protection of FGF23 by its O-glycosylation. Proc. Natl. Acad. Sci. USA doi: 10.1073/pnas.1815166116 (2019)
- Sakuragi T, Kosako H, Nagata S. Phosphorylation-mediated activation of mouse Xkr8 scramblase for phosphatidylserine exposure. Proc. Natl. Acad. Sci. USA 116: 2907-2912 (2019)
- Motani K, Kosako H. Activation of stimulator of interferon genes (STING) induces ADAM17-mediated shedding of the immune semaphorin SEMA4D. J. Biol. Chem. 293: 7717-7726 (2018)
- Sato M, Sato K, Tomura K, Kosako H, Sato K. The autophagy receptor ALLO-1 and the IKKE-1 kinase control clearance of paternal mitochondria in Caenorhabditis elegans. Nat. Cell Biol. 20: 81-91 (2018)
- Ishikawa E, Kosako H, Yasuda T, Ohmuraya M, Araki K, Kurosaki T, Saito T, Yamasaki S. Protein kinase D regulates positive selection of CD4+ thymocytes through phosphorylation of SHP-1. Nat. Commun. 7: 12756 (2016)
- Akabane S, Uno M, Tani N, Shimazaki S, Ebara N, Kato H, Kosako H, Oka T. PKA regulates PINK1 stability and Parkin recruitment to damaged mitochondria through phosphorylation of MIC60. Mol. Cell 62: 371-384 (2016)
- Shindo Y, Iwamoto K, Mouri K, Hibino K, Tomita M, Kosako H, Sako Y, Takahashi K. Conversion of graded phosphorylation into switch-like nuclear translocation via autoregulatory mechanisms in ERK signalling. Nat. Commun. 7: 10485 (2016)
- Koyano F, Okatsu K, Kosako H, Tamura Y, Go E, Kimura M, Kimura Y, Tsuchiya H, Yoshihara H, Hirokawa T, Endo T, Fon EA, Trempe JF, Saeki Y, Tanaka K, Matsuda N. Ubiquitin is phosphorylated by PINK1 to activate parkin. Nature 510: 162-166 (2014)
- Nakaya M, Tajima M, Kosako H, Nakaya T, Hashimoto A, Watari K, Nishihara H, Ohba M, Komiya S, Tani N, Nishida M, Taniguchi H, Sato Y, Matsumoto M, Tsuda M, Kuroda M, Inoue K, Kurose H. GRK6 deficiency in mice causes autoimmune disease due to impaired apoptotic cell clearance. Nat. Commun. 4: 1532 (2013)
- Kosako H, Yamaguchi N, Aranami C, Ushiyama M, Kose S, Imamoto N, Taniguchi H, Nishida E, Hattori S. Phosphoproteomics reveals new ERK MAP kinase targets and links ERK to nucleoporin-mediated nuclear transport. Nat. Struct. Mol. Biol. 16: 1026-1035 (2009)








