ユビキチン化による炎症・免疫シグナルの時空間制御とその数理シミュレーション
 研究分担者
研究分担者
徳永文稔
大阪市立大学 大学院医学研究科 分子病態学
http://osaka-cu-1seika.umin.jp/
研究概要
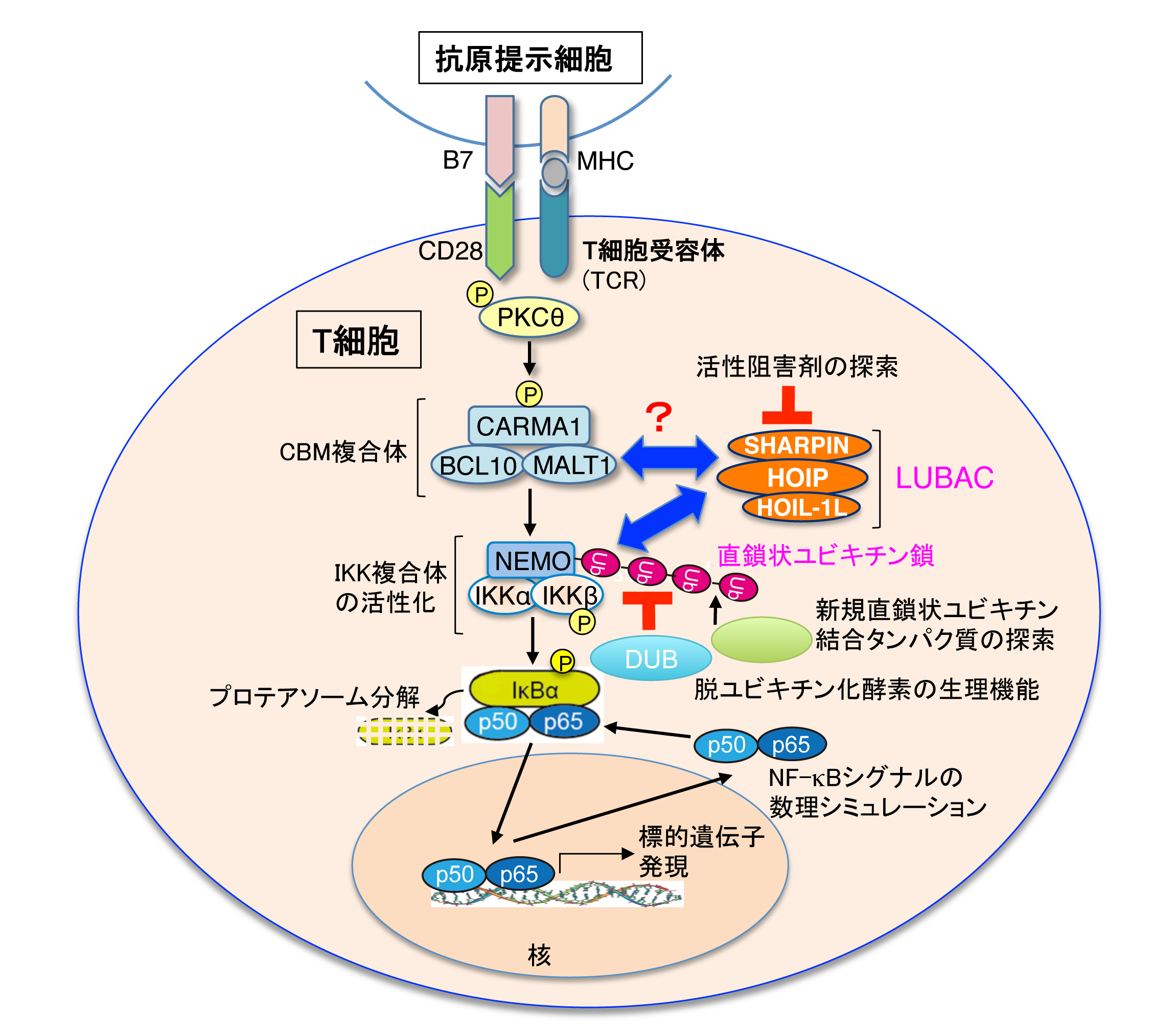
徳永グループは、ユビキチンのN末端Met1を介する直鎖状ポリユビキチン鎖(M1ユビキチン鎖)を特異的に生成するユビキチンリガーゼ(LUBAC)を発見し、M1ユビキチン鎖がNF-κBシグナル制御に重要な役割を司ることを明らかにしてきた。本研究では領域内各班と共同研究を行い、M1ユビキチン鎖を足場として発信される免疫・炎症シグナルの詳細な分子メカニズムと数理シミュレーションによる動態解析を目的に以下の研究を推進する。
(1)T細胞などのリンパ球は、線維芽細胞などに比較すると体積が極めて小さく、核容積率が高い。さらに、Tyrキナーゼや他の制御因子(CARMA1-Bcl10-MALT1など)が関わる複雑なNF-κB活性化経路を有する。そこで、鈴木班・久保田班と連携して数理シミュレーションによってT細胞受容体刺激に伴うNF-κB活性化を解析する。リンパ球という小細胞内でのNF-κBシグナル伝達の数理モデリングは極めて重要である。
(2)M1ユビキチン鎖によるNF-κBシグナル制御に関与する新規因子の同定とその作用機構の解析及び免疫・炎症反応における生理的意義の解明を目的に、澤崎班のコムギ無細胞系スクリーニング法により、M1ユビキチン鎖やLUBACに結合性を示す新規因子を同定し、シグナル制御における役割を解析する。また最近、NF-κBシグナル活性化にK63とM1の混成型ポリユビキチン鎖が関わることや、ユビキチンのリン酸化・アセチル化など翻訳後修飾も見出されており、井上班や尾山班と連携して新規修飾の生理的・病理的役割を解明する。さらに、同定したタンパク質の単独あるいは複合体の立体構造解析を石谷班とともに明らかにする。
(3)M1ユビキチン鎖を標的としたNF-κBシグナルの阻害剤及びバイオプローブを探索する目的で、澤崎班とともに炎症・免疫シグナル抑制に関与するユビキチンリガーゼや脱ユビキチン化酵素に対する低分子阻害剤のスクリーニングに着手する。同定された化合物に関して、上野班とともに化合物展開を検討し、生理機能検討からより薬効の高い創薬シーズを同定する。上野班とは、炎症・免疫刺激に伴うM1ユビキチン鎖生成・消散の細胞内イメージングや各種ユビキチン鎖生成の定量解析を行い、数理シミュレーションのパラメータとして用いる。
参考文献
- Nakazawa S, Oikawa D, Ishii R, Ayaki T, Takahashi H, Takeda H, Ishitani R, Kamei K, Takeyoshi I, Kawakami H, Iwai K, Hatada I, Sawasaki T, Ito H, Nureki O, and Tokunaga F. Linear ubiquitination is involved in the pathogenesis of optineurin-associated amyotrophic lateral sclerosis. Nat. Commun. (in press).
- Sato Y, Goto E, Shibata Y, Kubota Y, Yamagata A, Goto-Ito S, Kubota K, Inoue J, Takekawa M, Tokunaga F, and Fukai S. Structures of CYLD USP with Met1- or Lys63-linked diubiquitin reveal mechanisms for dual specificity. Nat. Struct. Mol. Biol. 22, 222-229, (2015).
- Tokunaga F, Nishimasu H, Ishitani R, Goto E, Noguchi T, Mio K, Kamei K, Ma A, Iwai K, and Nureki O. Specific recognition of linear polyubiquitin by A20 zinc finger 7 is involved in NF-κB regulation. EMBO J. 31, 3856-3870, (2012).
- Tokunaga F, Nakagawa T, Nakahara M, Saeki Y, Taniguchi M, Sakata S, Tanaka K, Nakano H, and Iwai K. SHARPIN is a component of the NF-κB-activating linear ubiquitin assembly complex. Nature 471, 633-636, (2011).
- Ikeda F, Deribe YL, Skånland SS, Stieglitz B, Grabbe C, van WijK S, Franz-Wachtel M, Goswami P, Nagy V, Terzic J, Tokunaga F, Androulidaki A, Nakagawa T, Pasparakis M, Iwai K, Sundberg JP, Schaefer L, Rittinger K, Macek B, and Dikic I. SHARPIN forms a linear ubiquitin ligase complex regulating NF-κB activity and apoptosis. Nature, 471, 637-641, (2011).
- Tokunaga F, Sakata S, Saeki Y, Satomi Y, Kirisako T, Kamei K, Nakagawa T, Kato M, Murata S, Yamaoka S, Yamamoto M, Akira S, Takao T, Tanaka K, and Iwai K. Involvement of linear polyubiquitylation of NEMO in NF-κB activation. Nat. Cell Biol. 11, 123-132, (2009).
- Kirisako T, Kamei K, Murata S, Kato M, Fukumoto H, Kanie M, Sano S, Tokunaga F, Tanaka K, and Iwai K. A ubiquitin ligase complex assembles linear polyubiquitin chains. EMBO J. 25, 4877-4887, (2006).
- Ishikawa H, Kato M, Hori H, Ishimori K, Kirisako T, Tokunaga F, and Iwai K. Involvement of heme regulatory motif in heme-mediated ubiquitination and degradation of IRP2. Mol. Cell 19, 171-181, (2005).
- Yamanaka K, Ishikawa H, Megumi Y, Tokunaga F, Kanie M, Rouault TA, Morishima I, Minato N, Ishimori K, and Iwai K. Identification of the ubiquitin-protein ligase that recognizes oxidized IRP2. Nat. Cell Biol. 5, 336-340, (2003).
- Yoshida Y, Chiba T, Tokunaga F, Kawasaki H, Iwai K, Suzuki T, Ito Y, Matsuoka K, Yoshida M, Tanaka K, and Tai T. E3 ubiquitin ligase that recognizes sugar chains. Nature418, 438-442, (2002).








