1細胞キナーゼ活性イメージングと数理解析により明らかになる骨格筋幹細胞の増殖制御
 研究代表者
研究代表者
冨田 太一郎
東邦大学 医学部生理学講座 統合生理学分野
http://www.toho-u.ac.jp/med/lab/lab_uniphysio.html
研究概要
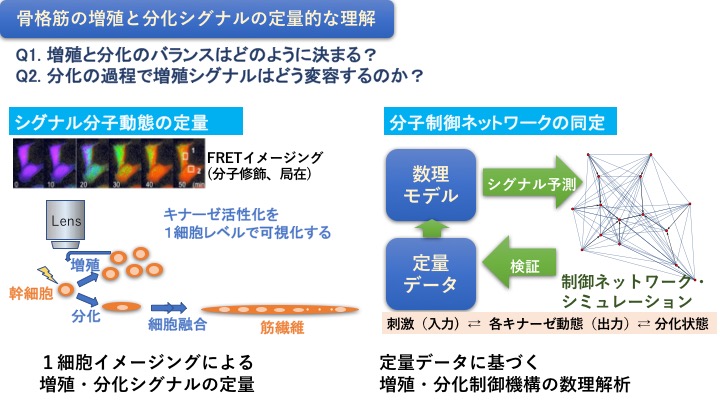
骨格筋はその幹細胞の増殖と分化のシグナルが適正に保たれることで維持されている。成体の骨格筋幹細胞は静止状態で骨格筋近傍に存在し、炎症などで筋損傷が生じるとこれが刺激となって細胞分裂を開始して増殖し、さらに分化と融合により巨大な筋繊維を形成する。骨格筋の増殖と分化を制御するシグナル分子についてはERK、p38などのMAPキナーゼやPI3K/AKTキナーゼ、また、カルシウムシグナルが重要な役割を果たしており、IGF(insulin-like growth factor)に代表される筋分化の増殖因子はこれらのシグナルを活性化させて筋の増殖や分化を制御することが知られている。しかしながら、筋細胞がどのように自らの増殖と分化を決定してそのバランスを調節するのかという本質的なメカニズムは未解明のままである。
これまで私たちは、細胞内シグナル伝達がどのような情報を基に細胞運命を決定するのかという問題に対して取り組み、1細胞レベルで生きた細胞のストレスシグナルや増殖シグナルのキナーゼ活性化動態をイメージング法で解明し、さらに、数理学的なシステム解析法を用いてその制御メカニズムを明らかにしてきた。その結果、p38やERKシグナル、およびカルシウムシグナルは強力なフィードバック制御を受けているために細胞内で予想外にダイナミックで複雑な時間変動を示すことを見出している。さらに、これらの複雑なシグナルの動的変化がサイトカインの発現やリン酸化などの分子間のシグナル伝達効率を変化させることも分かってきており、細胞運命決定におけるシグナル動態の重要性が明らかになりつつある。((Nat.Commun,2015、Sci.Signal,2012、JPS 2015)。したがって、骨格筋細胞においてもそのシグナルの時間的・空間的な動態が鍵となって増殖や分化を制御する可能性が考えられるが、骨格筋の細胞内シグナルがどのような挙動を示すのかは不明な点が多い。
そこで、本研究課題では、IGF経路のリン酸化シグナルが筋分化に伴いどのように変化するかを1細胞イメージングと数理解析を用いて定量的に解明する。特に、生きた筋細胞に系統的な摂動刺激を入力しながら、複数の連関するキナーゼ活性化シグナルの活性化動態をイメージング法で定量することにより、シグナル間にどのような相互作用やフィードバック制御が存在するかを明らかにし、同時に、数理学的なシステム解析手法により骨格筋の増殖シグナルと分化シグナルとの間の定量的な連関を理解したい。骨格筋は運動機能を担うだけでなく、さまざまな液性因子や代謝を担う器官でもあるため、筋制御シグナルの解明はがんや糖尿病などの疾患克服の観点からも急務の課題である。先鋭的なイメージング解析手法を駆使することにより、骨格筋制御機構の解明につなげたい。
参考文献
- Tomida T, Takekawa M and Saito H. Oscillation of p38 activity controls efficient pro-inflammatory gene expression. Nature Commun. 6: 8350 doi:10.1038/ncomms9350 (2015)
- Tomida T. Visualization of the spatial and temporal dynamics of MAPK signaling using fluorescence imaging techniques. Journal of Physiological Sci. 65: 37-49 doi:0.1007/s12576-014-0332-9 (2015)
- Ichikawa K, Kubota Y, Nakamura T, Weng JS, Tomida T, Saito H and Takekawa M. MCRIP1, an ERK substrate, mediates ERK-induced gene silencing during epithelial-mesenchymal transition by regulating the co-repressor CtBP. Molecular Cell 58: 35-46 (2015)
- Ohshima D, Arimoto-Matsuzaki K, Tomida T, Takekawa M and Ichikawa K. Spatio-temporal dynamics and mechanisms of stress-granule assembly. PLoS Comput. Biol. 11: e1004326 doi:10.1371/journal.pcbi.1004326 (2015)
- Tomida T, Oda S, Takekawa M, Iino Y and Saito H. The temporal pattern of stimulation determines the extent and duration of MAPK activation in a caenorhabditis elegans sensory neuron. Science Signaling 5, ra76 (2012)
- Tomida T, Takekawa M, O’Grady P and Saito H. Stimulus-specific distinctions in spatial and temporal dynamics of stress-activated protein kinase kinase kinases revealed by FRET biosensor. Mol. Cell. Biol. 29, 6117-6127 (2009)
- Tomida T, Hirose K, Takizawa A, Shibasaki F and Iino M. NFAT functions as a working memory of Ca2+ signals in decoding Ca2+ oscillation. EMBO J. 22, 3825-3832 (2003)








