B細胞分化誘導を特異的にエンコードするシグナル動態の制御機構
 研究代表者
研究代表者
篠原久明
国立研究開発法人理化学研究所
http://www.ims.riken.jp/labo/57/index_j.html
研究概要
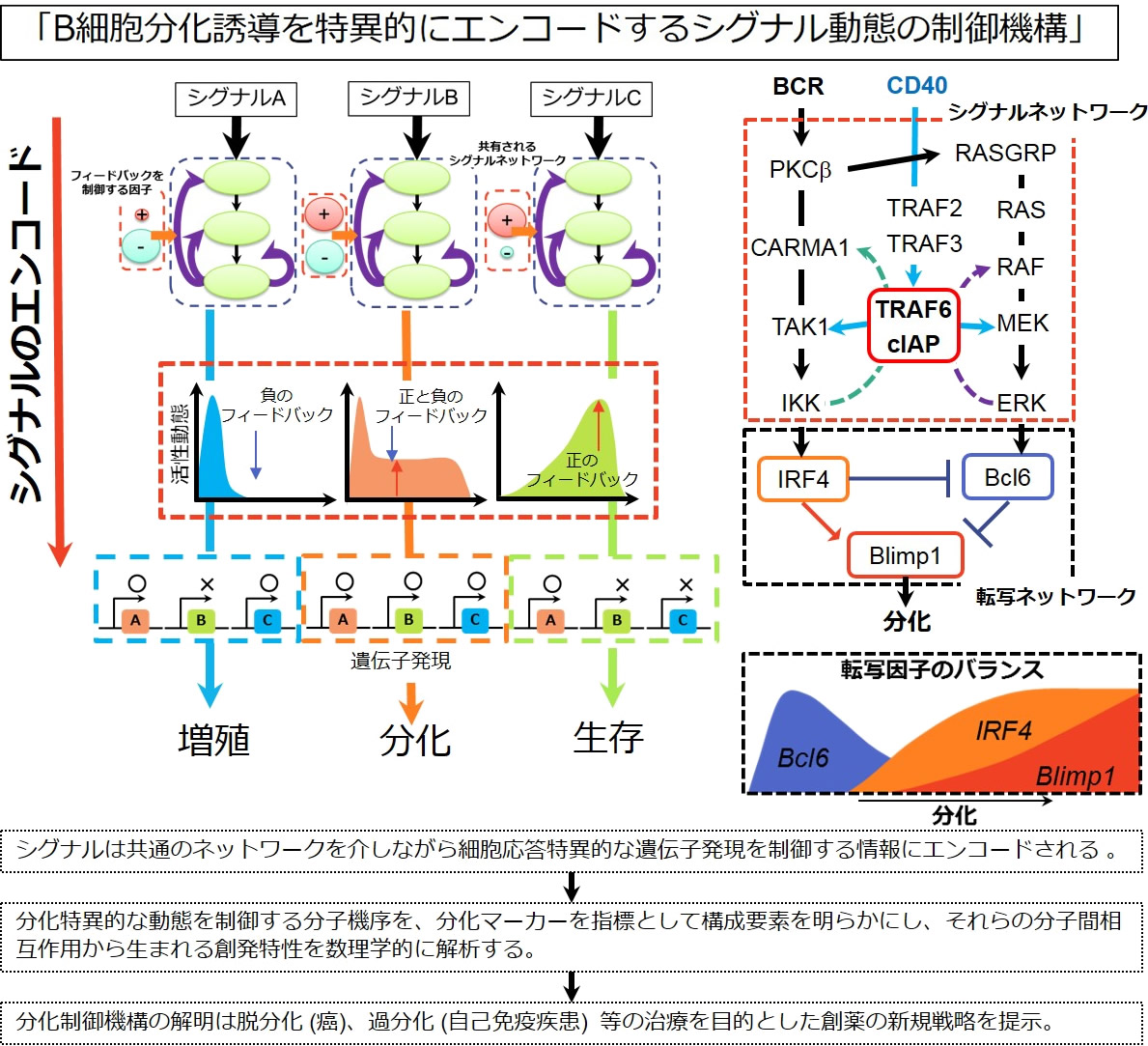
様々な刺激により誘導されるシグナルは、共通のネットワークを介しながら細胞応答特異的な遺伝子発現を制御する情報に変換 (エンコード) される。共通のネットワークを使いながらシグナルを生物応答特異的な情報にエンコードするのは、活性動態であると考えられている。しかしながら、インプット (刺激) とこれをエンコードするシグナルネットワーク、及び生物学的出力 (分化) に復号する遺伝子発現制御ネットワークの組み合わせは無限であり、実験により全てを検証することは現実的ではない。
B細胞は病原体を抗原受容体 (BCR) で認識し、CD40等の協同して機能する受容体からのシグナルにより抗体産生細胞に分化する。BCRとCD40はシグナル経路 (シグナルネットワーク) を共有しているが、それぞれの受容体から誘導される活性化動態については未だ解析は進んでいない。様々な刺激に対して定性的に同一の分子が活性化されるにも拘らず異なる細胞応答を生み出す機構は、時間情報により複雑な分子の反応連鎖、フィードバック機構、クロストークを統合し、生理的応答に変換している (図)。
B細胞はBCRシグナルが一定量活性しなければ増殖・分化しない。その制御として活性の閾値を決める分子機構の存在が示唆されていた。研究代表者はBCRシグナルについて詳細な分子動態の計測と数理モデルを駆使し、正のフィードバック機構が機能していることを証明し、この機構がB細胞に内在する活性化のスイッチ様出力の閾値を設定することを明らかにしている。さらにBCRとCD40で誘導される遺伝子発現を解析することにより、NF-κB活性の動態制御に関わる制御因子を解析し、リン酸化酵素IKK (NF-κB活性化酵素) のSteepな活性動態はB細胞の活性に、 Gradual活性は生存に必要であるという知見を得ている。しかしながらNF-κB活性動態のみを操作しても分化関連遺伝子の発現の制御は困難である。
「多様な活性動態を生み出しているのはフィードバックを制御する因子である」という作業仮説に基づき、本課題ではIKKのみでなくERKを含むネットワークを対象に定量解析する。B細胞の分化特異的なシグナル活性動態を制御する分子機序を、分化マーカーを指標として構成要素を明らかにし、それらの分子間相互作用から生まれる機能的性質、つまりフィードバック制御という創発特性を数理学的に解析する。この解析により細胞分化特異的に影響を与える蛋白修飾を明らかにする。人為的な動態の操作を可能にすることにより、脱分化 (癌)、過分化 (自己免疫疾患) などの副作用のない治療、創薬の新規戦略を提示することに繋げたい。
参考文献
- Inoue K†, Shinohara H†, Behar M, Yumoto N, Tanaka G, Hoffmann A, Aihara K, Okada-Hatakeyama M. (†equal contribution) Oscillation Dynamics Underlies Functional Switching of NF-kB for B Cell Activation. npj Systems Biology and Applications2016, 2: 16024.
- Shinohara H*, Yasuda T, Kurosaki T. (*corresponding author) TAK1 adaptor protein TAB2 and TAB3 connect signalosome for B cell receptor induced IKK activation in DT40 B cells. FEBS Letters. 2016, 590(18):3264-9.
- Shinohara H*, Inoue K, Yumoto N, Nagashima T, and Okada-Hatakeyama M*. (*corresponding author) Stimulus-Dependent Inhibitor of Apoptosis Protein Expression Prolongs the Duration of B Cell Signalling. Scientific Reports 2016, 6:27706.
- Shinohara H*, and Kurosaki T*. (*corresponding author) Negative role of TAK1 for marginal zone B-cell development incidental to activation of the NF-kB non-canonical pathway. Immunology and Cell Biology 2016, 94(9):821-829.
- Shinohara H, Behar M, Inoue K, Hiroshima M, Yasuda T, Nagashima T, Kimura S, Sanjo H, Maeda S, Yumoto N, Ki S, Akira S, Sako Y, Hoffmann A, Kurosaki T, and Okada-Hatakeyama M. Positive feedback within a kinase signaling complex functions as a switch mechanism for NF-kB activation. Science 2014, 344: 760-764.
- Kurosaki T, Shinohara H, Baba Y. B cell signaling and fate decision. Annual Review of Immunology2010, 28: 21-55.
- Shinohara H*, and Kurosaki T. (*corresponding author) Comprehending the complex connection between PKCb, TAK1, and IKK in BCR signaling. Immunological Reviews 2009, 232(1): 300-18.
- Shinohara H, Maeda S, Watarai H, Kurosaki T. IkB kinaseb-induced phosphorylation of CARMA1 contributes to CARMA1 Bcl10 MALT1 complex formation in B cells. The Journal of Experimental Medicine 2007, 204(13):3285-93.
- Shinohara H, Yasuda T, Aiba Y, Sanjo H, Hamadate M, Watarai H, Sakurai H, Kurosaki T. PKCb regulates BCR-mediated IKK activation by facilitating the interaction between TAK1 and CARMA1. The Journal of Experimental Medicine 2005, 202(10):1423-31.








