自然炎症の惹起に関わるシグナル伝達経路のプロテオーム解析
 研究代表者
研究代表者
齊藤達哉
徳島大学 先端酵素学研究所 炎症生物学分野
http://saitohtatsuya.wixsite.com/saitohlab
研究概要
自然免疫機構は体内に侵入した病原体を感知し、サイトカインなどの炎症性因子を産生することで、その排除を行う重要な生体防御機構である。一方で、自然免疫機構は病原体以外の物質に誤って反応し、非感染性の炎症“自然炎症”を惹起することにより、様々な疾患の発症要因となる。本公募班では、不明な点が多く残されている自然炎症のシグナル伝達に関する研究を展開する。
研究代表者は、新学術領域研究「修飾シグナル病」などの科研費のサポートを受けて、自然免疫の制御機構及びその病態生理学的意義に関する研究をこれまでに行ってきた。一連の研究により、自然免疫機構のシグナル伝達には、エンドソーム、リソソーム、ファゴソーム、オートファゴソーム、アズール顆粒、脂肪滴、ゴルジ体、小胞体、ミトコンドリアなど、様々なオルガネラが関わることを明らかにしている。研究を進めていく過程で、オルガネラが協調して織り成す自然免疫の複雑なシグナル伝達ネットワークを真に理解するためには、数理科学的なアプローチが必要であると考えるに至り、プロテオーム解析を中心とする本研究を立案した。
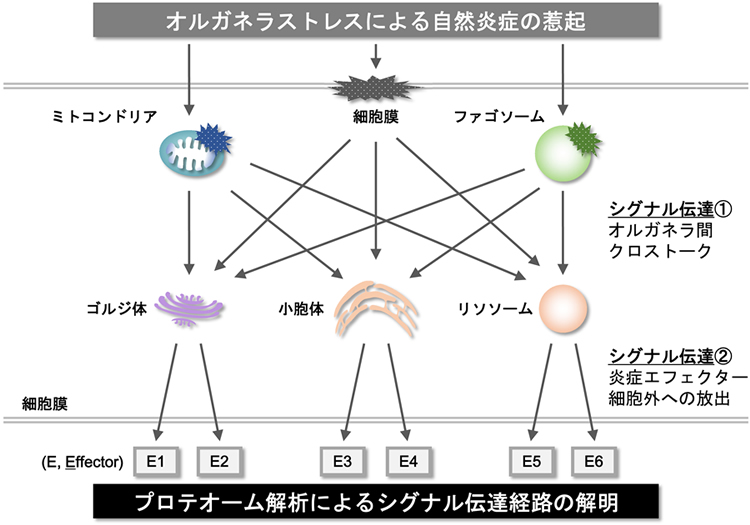
ウイルスや細菌によって引き起こされるオルガネラストレスは、自然免疫を介した炎症応答の起点として機能する。オルガネラストレスは自然炎症応答の起点としても機能しており、死細胞から放出されたATPの刺激に応じたミトコンドリアの損傷、尿酸塩結晶などの代謝物によるファゴソームの損傷、活性酸素種による細胞膜の損傷などは、自然炎症を強く惹起する。しかしながら、ストレスを受けたオルガネラの種別が炎症性因子の放出にどのような違いを生み出すのか?どのようなシグナル伝達経路がそれらの違いを生み出しているのか?など、解明するべき研究課題が数多く存在する。そこで本研究では、プロテオーム解析によりオルガネラストレスに応じて細胞内で発現量・修飾状態の変動する因子や細胞外に放出される因子を同定し、自然炎症誘導に関わるシグナル伝達ネットワークを明らかにする。さらに、特に重要と思われるシグナル伝達因子や炎症性因子については、自然炎症に起因する疾患への関与や時空間制御についての解析も行うことにより、データ集積のみにとどまることなく、真に意味のあるシグナル伝達マップを作成する。
参考文献
- Kozaki T, Komano J, Kanbayashi D, Takahama M, Misawa T, Satoh T, Takeuchi O, Kawai T, Shimizu S, Matsuura Y, Akira S, Saitoh T. Mitochondrial damage elicits a TCDD-inducible poly(ADP-ribose) polymerase-mediated antiviral response. Proc Natl Acad Sci U S A. 114, 2681-2686 (2017)
- Saitoh T, Akira S. Regulation of the inflammasomes by autophagy. J Allergy Clin Immunol. 138, 28-36 (2016)
- #Misawa T, #Saitoh T, Kozaki T, Park S, Takahama M, Akira S (#Equal contribution). Resveratrol inhibits the acetylated α-tubulin-mediated assembly of the NLRP3-inflammasome. Int Immunol. 27, 425-434 (2015)
- Misawa T, Takahama M, Kozaki T, Lee H, Zou J, *Saitoh T, *Akira S (*Co-corresponding authors). Microtubule-driven spatial arrangement of mitochondria promotes activation of the NLRP3 inflammasome. Nat Immunol. 14, 454-460 (2013)
- Lee H, Komano J, Saitoh Y, Yamaoka S, Kozaki T, Misawa T, Takahama M, Satoh T, Takeuchi O, Yamamoto N, Matsuura Y, *Saitoh T, *Akira S (*Co-corresponding authors). Zinc-finger antiviral protein mediates retinoic acid inducible gene I-like receptor-independent antiviral response to murine leukemia virus. Proc Natl Acad Sci U S A. 110, 12379-12384 (2013)
- Saitoh T, Komano J, Saitoh Y, Misawa T, Takahama M, Kozaki T, Uehata T, Iwasaki H, Omori H, Yamaoka S, Yamamoto N, Akira S. Neutrophil extracellular traps mediate a host defense response to human immunodeficiency virus-1. Cell Host Microbe. 12, 109-116 (2012)
- Saitoh T, Satoh T, Yamamoto N, Uematsu S, Takeuchi O, Kawai T, Akira S. Antiviral protein Viperin promotes Toll-like receptor 7- and Toll-like receptor 9-mediated type I interferon production in plasmacytoid dendritic cells. Immunity. 34, 352-363 (2011)
- Saitoh T, Fujita N, Hayashi T, Takahara K, Satoh T, Lee H, Matsunaga K, Kageyama S, Omori H, Noda T, Yamamoto N, Kawai T, Ishii K, Takeuchi O, Yoshimori T, Akira S. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response. Proc Natl Acad Sci U S A. 106, 20842-20846 (2009)
- Saitoh T, Fujita N, Jang MH, Uematsu S, Yang BG, Satoh T, Omori H, Noda T, Yamamoto N, Komatsu M, Tanaka K, Kawai T, Tsujimura T, Takeuchi O, Yoshimori T, Akira S. Loss of the autophagy protein Atg16L1 enhances endotoxin-induced IL-1β production. Nature. 456, 264-268 (2008)
- Saitoh T, Tun-Kyi A, Ryo A, Yamamoto M, Finn G, Fujita T, Akira S, Yamamoto N, Lu KP, Yamaoka S. Negative regulation of interferon-regulatory factor 3-dependent innate antiviral response by the prolyl isomerase Pin1. Nat Immunol. 7, 598-605 (2006)








