mTORC1栄養シグナル制御の分子基盤解析
研究代表者
岡田雅人
大阪大学 微生物病研究所 発癌制御研究分野
http://www.biken.osaka-u.ac.jp/biken/oncogene/index.htm
研究概要
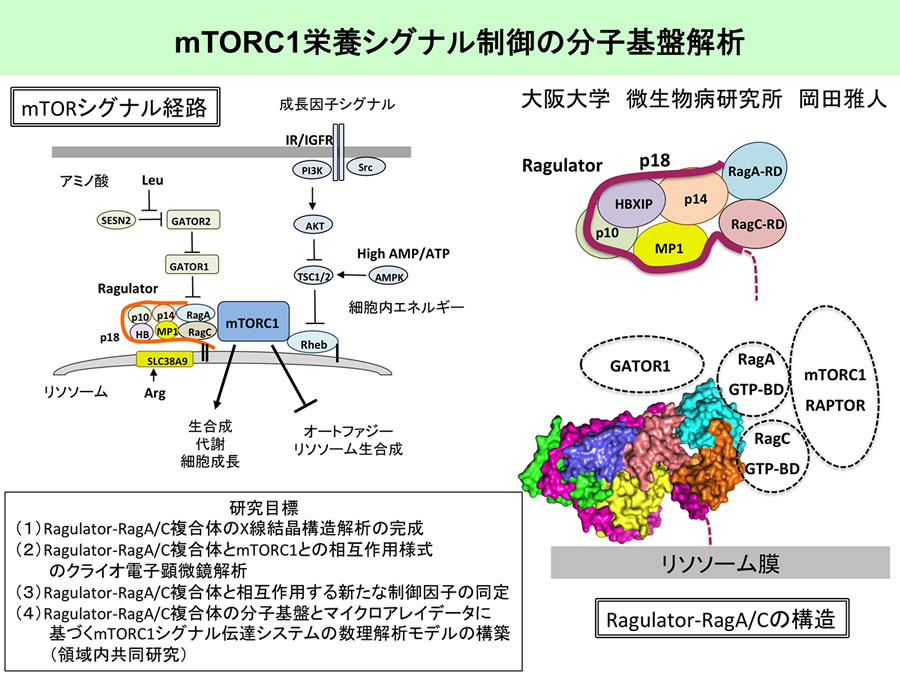
真核細胞は、成長因子による刺激、細胞内外からの栄養素や細胞内エネルギーを用いて、その構成素材であるタンパク質、脂質、核酸などを同化あるいは異化することによって成長・増殖・分化し、細胞および個体生命を維持している。こうした生命の基本システムを統御する分子として、免疫抑制や抗がん作用のあるマクロライド系抗生物質Rapamycinの標的として同定されたmTORC1(mechanistic Target Of Rapamycin, Complex 1)が近年注目されている。mTORC1はmTOR キナーゼとRaptorなどの制御因子から構成されるタンパク質複合体である。mTORC1キナーゼは、タンパク質、脂質、核酸などの生合成を促進する多様な因子をリン酸化することによって同化反応を促進し、また、栄養欠乏状態においては、オートファジーやリソソーム生合成を促進することによって異化反応を促進する機能を持つ。
mTORC1の活性制御機構については、近年爆発的に研究が進展し、その全貌が明らかになりつつある(1, 2)。mTORC1はその主要な部分が細胞質側のリソソーム膜表面に局在化することによって活性化する。リソソーム膜表面にはRheb GTPaseが存在し、その活性型との相互作用によってmTORC1キナーゼが活性化する。Rhebの活性は、TSC1/2 GAPによって通常抑制されているが、TSC1/2がインスリンなどの成長因子シグナル下流のPI3K-AKT経路を介してリン酸化されると活性抑制され、結果としてRhebが活性される。また、TSC1/2は、AMP/ATP比の上昇によって活性化するAMPキナーゼによってリン酸化されて活性化し、その結果Rheb-mTORC1を不活性化する。こうした経路を介して、mTORC1は成長因子シグナルや細胞内エネルギー状態に応答して活性調節を受ける。また、PI3K-AKT-TSC-mTORC1経路には、ヒトがんにおいて高頻度に変異しているがん遺伝子(PI3K、AKT、mTOR)やがん抑制遺伝子(PTEN、TSC1/2)が位置していることから、がんの発生や進展に関わる重要なシグナル経路として薬剤標的ともなっている。
一方で、mTORC1は栄養素、特にアミノ酸を感知して、主にリソソーム膜表面に局在化することにより活性化する。そのリクルートには、リソソーム膜表面上でRagA/C2量体GTPaseの活性化が必要であり、また、RagA/Cのリソソームへの特異的な局在化は、“Ragulator”と呼ばれる5量体タンパク質(p18、p14、MP1、p10、HBXIP)を介することも明らかとなっている(1)。アミノ酸を感知してRagA/Cを活性化する因子に関しては、GATOR1/2というRagA/CのGAPを制御するSestrin2や、SLC38A9というリソソーム膜に局在するアミノ酸トランスポーターなど多くの候補分子が同定されてきている。このように、mTORC1がきわめて多様な因子を介して、厳密かつ巧妙に制御されることによって、細胞の恒常性が維持されていることが示されつつあるが、アミノ酸感受機構の実体など不明な点がまだ多く残されている。
我々は、EGF受容体のエンドソーム系を介する制御機構を解析する過程において、リソソーム膜のマイクロドメインに特異的に局在するアダプター様タンパク質としてp18を初めて同定した(3)。その後の解析によりp18(LAMTOR1)が、他の二量体タンパク質p14-MP1およびHBXIP-p10と5者複合体(Ragulator)を形成し、RagA/CをリクルートすることによってmTORC1をリソソーム膜上で活性化する機能を持つことが明らかとなった。また、p18-mTORC1経路が、細胞成長、物質代謝や細胞の終末分化など多様な生命現象においてきわめて重要な役割を担うことを示してきた(4-10)。しかしながら、p18をcoreとするRagulator-RagA/C複合体の機能や制御機構の分子機序に関しては不明な点が多く残されている。特に、RagulatorがRagA/CのGEFとして機能してmTORC1の活性制御に直接関わるという報告もあるが、その分子レベルでの検証が待望されている。また、Ragulator-RagA/C複合体とmTORC1の相互作用が重要な制御ポイントとなるが、そこを標的とした薬剤開発の基盤となる分子構造情報はまだ全く得られていない。さらに近年、アミノ酸感知に関わる多様な因子が同定されてきているが、未だに決定的なものはなく、その実体解明がmTORC1シグナルの制御機構に関わる最重要課題として残されている。そこで本研究では、mTORC1シグナル伝達システムの制御機構の全貌解明とその破綻による疾患との関連性を統合的に理解することを目指して、まず、構造生物学および生化学的手法によってmTORC1の機能と制御機構の分子基盤を明らかにし、その情報に基づいたWetなシグナル解析データや、Ragulatorの機能欠損細胞のマイクロアレイデータ等を利用して数理解析モデルの構築を試みる。
参考文献
- Sancak Y, Bar-Peled L, Zoncu R, Markhard AL, Nada S, Sabatini DM. Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessary for its activation by amino acids. Cell 141:290-303, 2010
- Saxton, RA., Sabatini, DM. mTOR Signaling in Growth, Metabolism, and Disease. Cell 168: 960-976, 2017
- Nada S, Hondo A, Kasai A, Koike M, Saito K, Uchiyama Y, Okada M. The novel lipid raft adaptor p18 controls endosome dynamics by anchoring the MEK-ERK pathway to late endosomes. EMBO J. 28, 477-489, 2009
- Kimura T, Nada S, Takegahara N, OkunoT, NojimaS, Kang S, Ito D, Morimoto K, Hosokawa T, Hayama Y, Mitsui Y, Sakurai N, Sarashina-Kida H, Nishide M, Maeda Y, Takamatsu H, Okuzaki D, Yamada M, Okada M, Kumanogoh A: Polarization of M2 macrophages requires Lamtor1 that integrates cytokine and amino-acid signals, Nat Commun7:13130, 2016
- Kakumoto K, Ikeda J, Okada M, Morii E, Oneyama C: mLST8 Promotes mTOR-Mediated Tumor Progression. PLoS One. 10: e0119015, 2015
- Nada S, Mori S, Takahashi Y, Okada M: p18/LAMTOR1: a late endosome/lysosome-specific anchor protein for the mTORC1/MAPK signaling pathway. Methods Enzymol. 535: 249-263, 2014
- Mori S, Nada S, Kimura H, Tajima S, Takahashi Y, Kitamura A, Oneyama C, Okada M. The mTOR pathway controls cell proliferation by regulating the FoxO3a transcription factor via SGK1 kinase. PLos One. 9: e88891, 2014
- Soma-Nagae T, Nada S, Kitagawa M, Takahashi Y, Mori S, Oneyama C, Okada M: The lysosomal signaling anchor p18/LAMTOR1 controls epidermal development by regulating lysosome-mediated catabolic processes. J Cell Sci 126: 3575-3584, 2013
- Takahashi Y, Nada S, Mori S, Soma-Nagae T, Oneyama C, Okada M: The late endosome/lysosome-anchored p18-mTORC1 pathway controls terminal maturation of lysosomes. Biochem Biophys Res Commun 417: 1151-1157, 2012
- Yoshida S, Hong S, Suzuki T, Nada S, Mannan AM, Wang J, Okada M, Guan KL, Inoki K: Redox regulates mammalian target of rapamycin complex 1 (mTORC1) activity by modulating the TSC1/TSC2-Rheb GTPase pathway. J Biol Chem 286: 32651-32660, 2011








