細胞外の多様な環境硬度に応じた細胞分化を制御するHippo-YAPシグナルの解析
 研究代表者
研究代表者
仁科博史
東京医科歯科大学・難治疾患研究所・教授
http://www.tmd.ac.jp/mri/dbio/
研究概要
ヒトの体内には、柔らかな血液(弾性係数50Pa)や 脳(70Pa), 肺(200Pa), 乳房(1,000Pa)から硬い骨(1GPa)まで多様な細胞外環境の組織や器官が存在している(Butcher et al. Nat Rev Cancer 2009)。各組織の幹/前駆細胞は、この多様な硬さの細胞外環境(環境硬度)に適応し、細胞分化し、機能を果たす。また、がん化した乳房内では、硬い細胞外環境(5,000Pa)へと変化するが、がん細胞は適応し生存する。最近、間葉系幹細胞が、環境硬度に応じて、神経細胞や筋芽細胞, 骨芽細胞へ分化すること、器官サイズとがん化を制御するHippo-YAPシグナル伝達経路が環境硬度に応答し、間葉系幹細胞の脂肪細胞や骨芽細胞分化に関与することが報告され、国内外の注目を集めている(Dupont et al. Nature2011)。本発見は、従来の研究では2-4GPaの非常に硬いプラスチックやガラスを用いた細胞培養であったため、見過ごされてきた知見と言える。しかしながら、幹細胞がどのように異なる環境硬度を認識し、多様な細胞分化を誘導するのか、また、Hippo-YAPシグナルがどのように環境硬度に適応し、多様な細胞分化誘導に関与するかは不明のままである。我々はこれまでに、マウスES細胞を用いて、“細胞分化の入り口”と呼ばれる原始線条様構造を胚様体内に形成し、三胚葉へと分化誘導するユニークな細胞培養系の確立に成功している(Scientific Reports 2016 a)。また、メダカの転写共役因子YAPが細胞内骨格のアクトミオシン系を通して、細胞張力や細胞外基質のフィラミンの重合化を制御し、組織や器官の三次元(3D)構築に関与すること(Nature 2015)、腎臓上皮MDCK細胞で活性化YAPを発現すると隣接細胞に依存した細胞排除が生じること(Scientific Reports 2016 b)、活性化YAPを発現する肝細胞は肝障害の有無でその動態の運命が変化すること(Nature Commun 2017)などHippo-YAPシグナル研究の実績がある。そこで本研究では、これらの研究成果を踏まえて、多能性を有するマウスES細胞を用いて、環境硬度をどのように受容し、細胞分化能がどのように変化するかを、主にHippo-YAPシグナルの観点から、解明することを目的とする。
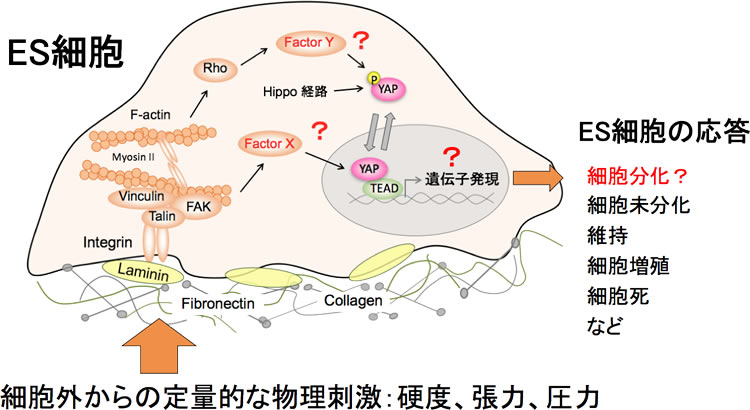
今後の研究目的
ES細胞は細胞外環境からの定量的な物理刺激をどのように受容しているのか?
細胞分化におけるYAPの役割はなにか?
参考文献
- Norio Miyamura, Shoji Hata, Tohru Itoh, Minoru Tanaka, Miki Nishio, Michiko Itoh, Yoshihiro Ogawa, Shuji Terai, Akira Suzuki, Isao Sakaida, Atsushi Miyajima and Hiroshi Nishina (2017). YAP determines the cell fate of injured mouse hepatocytes in vivo. Nature Communications 8, 16017.
- Yoshimi Okamoto-Uchida, Ruoxing Yu, Norio Miyamura, Norie Arima, Mari Ishigami-Yuasa, Hiroyuki Kagechika, Suguru Yoshida, Takamitsu Hosoya, Makiko Nawa, Takeshi Kasama, Yoichi Asaoka, Reiner Wimmer Alois, Ulrich Elling, Josef M. Penninger, Sachiko Nishina, Noriyuki Azuma and Hiroshi Nishina (2016) The mevalonate pathway regulates primitive streak formation via protein farnesylation. Scientific Reports6, 37697.
- Takanori Chiba, Erika Ishihara, Norio Miyamura, Rika Narumi, Mihoko Kajita, Yasuyuki Fujita, Akira Suzuki, Yoshihiro Ogawa, Hiroshi Nishina (2016) Active form of YAP expressing MDCK cells are extruded apically depending on neighboring cells status. Scientific Reports6, 28383.
- Sean Porazinski, Huijia Wang, Yoichi Asaoka, Martin Behrndt1, Tatsuo Miyamoto, Hitoshi Morita, Shoji Hata, Takashi Sasaki, S.F. Gabby Krens, Yumi Osada, Satoshi Asaka, Akihiro Momoi, Sarah Linton, Joel B. Miesfeld, Brian A. Link, Takeshi Senga, Atahualpa Castillo-Morales, Araxi O. Urrutia, Nobuyoshi Shimizu, Hideaki Nagase, Shinya Matsuura, Stefan Bagby, Hisato Kondoh, *Hiroshi Nishina, *Carl-Philipp Heisenberg and *Makoto Furutani-Seiki (2015) YAP is essential for tissue tension to ensure vertebrate 3D body shape. Nature 521, 217-221 (*Corresponding authors)
- Ruoxing Yu, Norio Miyamura, Yoshimi Okamoto-Uchida, Norie Arima, Mari Ishigami-Yuasa, Hiroyuki Kagechika and Hiroshi Nishina (2015) A Modified Murine Embryonic Stem Cell Test for Evaluating the Teratogenic Effects of Drugs on Early Embryogenesis. PLoS ONE 10 e0145286.
- Yoichi Asaoka, Shoji Hata, Misako Namae, Makoto Furutani-Seiki, and Hiroshi Nishina (2014) Hippo pathway controls a switch between retinal proliferation and photoreceptor cell differentiation in zebrafish. PLoS ONE 9, e97365.
- Menno J. Oudhoff, Spencer A. Freeman, Amber L. Couzens, Frann Antignano, Ekaterina Kuznetsova, Paul H. Min, Jeffrey P. Northrop, Bernhard Lehnertz, Dalia Barsyte-Lovejoy, Masoud Vedadi, Cheryl H. Arrowsmith, Hiroshi Nishina, Michael R. Gold, Fabio M.V. Rossi, Anne-Claude Gingras, and Colby Zaph (2013) Control of the Hippo pathway by Set7-dependent methylation of Yap. Dev. Cell 26, 188-194.
- Shoji Hata, Jun Hirayama, Hiroaki Kajiho, Kentaro Nakagawa, Yutaka Hata, Toshiaki Katada, Makoto Furutani-Seiki and Hiroshi Nishina (2012) A novel acetylation cycle of the transcription co-activator Yes-associated protein that is downstream of the Hippo pathway is triggered in response to SN2 alkylating agents. J. Biol. Chem. 287, 22089-22098.
- Yoshimi Uchida, Tomomi Osaki, Tokiwa Yamasaki, Tadanori Shimomura, Shoji Hata, Takeshi Todo, Jun Hirayama, and Hiroshi Nishina (2012) Involvement of the stress kinase MKK7 in the regulation of mammalian circadian clock. J. Biol. Chem.287, 8318-8326.
- Tokiwa Yamasaki, Hiroshi Kawasaki, Satoko Arakawa, Kimiko Shimizu, Shigeomi Shimizu, Orly Reiner, Hideyuki Okano, Sachiko Nishina, Noriyuki Azuma, Josef M. Penninger, Toshiaki Katada and Hiroshi Nishina (2011) Stress-activated protein kinase MKK7 regulates axon elongation in the developing cerebral cortex. J. Neurosci. 31, 16872-16883.








