PI3Kシグナルと幹細胞動態の階層的数理解析による自己組織化機構の解明
 研究代表者
研究代表者
難波大輔
東京医科歯科大学 難治疾患研究所 幹細胞医学分野
http://www.tmd.ac.jp/mri/scm/
研究概要
多くの組織の恒常性は、組織特異的幹細胞を中心とした幹細胞システムによって維持されている。幹細胞は自己を複製するだけでなく、分化にコミットした前駆細胞や、分化細胞を生み出すことで組織構造を維持しているが、組織が損傷を受けた場合、幹細胞は迅速に前駆細胞や分化細胞を生み出し組織の再生を行う。この過程では、多くの細胞内シグナル伝達経路が活性化されるが、組織再生時の幹細胞内シグナル伝達経路活性化とそれに伴う幹細胞動態の定量的理解は未だに不十分であり、このことが幹細胞からの組織再生の制御を難しくしている。
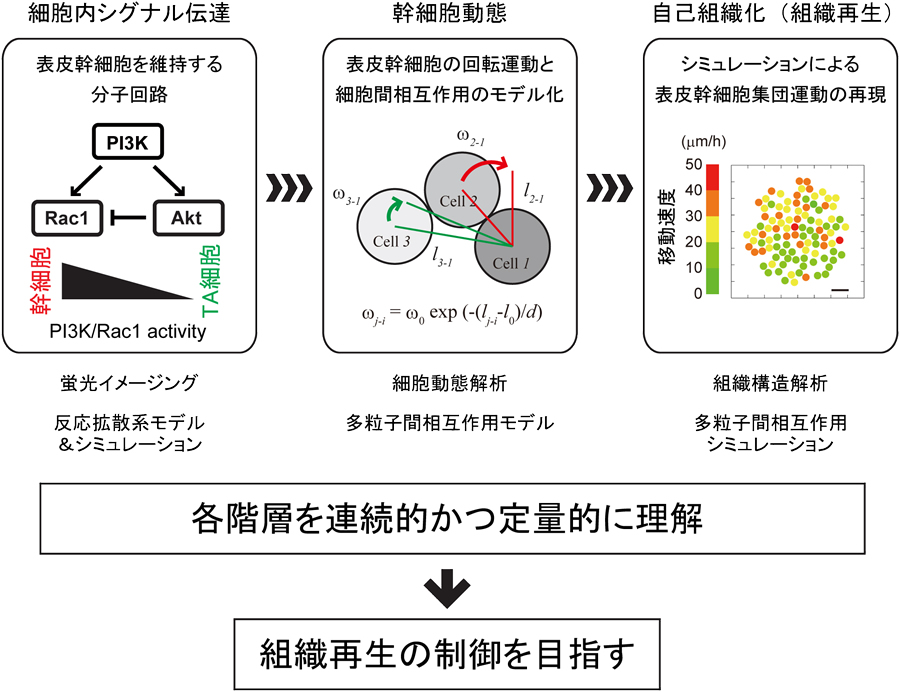
ヒト表皮幹細胞は、培養系において自発的に生体における表皮と同様の多層化した上皮構造を形成する。これは幹細胞からの組織再生過程をin vitroにおいて再現できる極めて優れた系であり、この系において、イメージング技術と数理解析手法を駆使することで、幹細胞内シグナル伝達経路の変化→幹細胞動態の変化→組織再生という過程を、分子から組織のレベルまで横断的かつ定量的に理解することが可能である。本研究では、ヒト表皮幹細胞培養系をモデルとし、幹細胞内シグナル伝達経路の活性化→幹細胞動態変化→多細胞集団の再構築(自己組織化)という過程を、PI3Kシグナル活性の蛍光イメージングとその反応拡散系モデル、さらに多細胞間相互作用の物理モデルによる細胞集団動態解析を融合することで、階層的に理解することを目的とする。
我々はこれまでに、PI3Kシグナルによるヒト表皮幹細胞のアクチン骨格制御(Nanba et al., EMBO Mol. Med. 2013)とヒト表皮幹細胞特有の回転運動 (Nanba et al., J. Cell Biol. 2015) を明らかにしてきた。さらに、多粒子間相互作用の物理学を基盤とした培養ヒト表皮幹細胞運動の数理モデル化と、それを用いたシミュレーションによって、表皮幹細胞運動の再現や数値計算による幹細胞集団動態の予測に成功している(Nanba et al., J. Cell Biol. 2015)。本研究課題では、これらの研究を発展させ、ヒト表皮幹細胞からの自発的な表皮組織形成過程を、分子・細胞・多細胞の各階層を連続的かつ定量的に理解することを目指す。また、糖尿病罹患ヒト表皮幹細胞でも同様の実験を行うことで、糖尿病による組織再生不良が、幹細胞内シグナル伝達経路のどこに起因するかを定量的に明らかにする。
参考文献
- Hiraoka C, Toki F, Shiraishi K, Sayama K, Nishimura EK, Miura H, Higashiyama S, and Nanba D. Two clonal types of human skin fibroblasts with different potentials for proliferation and tissue remodeling ability. J. Dermatol. Sci. 82: 84-94 (2016).
- Fukuda S, Nishida-Fukuda H, Nanba D, Nakashiro K, Nakayama H, Kubota H, and Higashiyama S. Reversible interconversion and maintenance of mammary epithelial cell characteristics by ligand-regulated EGFR systems. Sci. Rep. 6: 20209 (2016).
- Tate S, Imai M, Matsushita N, Nishimura EK, Higashiyama S, and Nanba D. Rotation is the primary motion of paired human epidermal keratinocytes. J. Dermatol. Sci. 79: 194-202 (2015).
- Nanba D, Toki F, Tate S, Imai M, Matsushita N, Shiraishi K, Sayama K, Toki H, Higashiyama S, and Barrandon Y. Cell motion predicts human epidermal stemness. J. Cell Biol. 209: 305-315 (2015).
- Toki F, Honkura N, Shirakata Y, Imamura T, Higashiyama S, and Nanba D. Second harmonic generation reveals collagen fibril remodeling in fibroblast-populated collagen gels. Cell Struct. Funct. 38: 227-236 (2013).
- Nanba D, Toki F, Barrandon Y, and Higashiyama S. Recent advances in the epidermal growth factor receptor/ligand system biology on skin homeostasis and keratinocyte stem cell regulation. J. Dermatol. Sci. 72: 81-86 (2013).
- Nanba D, Matsushita N, Toki F, and Higashiyama S. Efficient expansion of human keratinocyte stem/progenitor cells carrying a transgene with lentiviral vector. Stem Cell Res. Ther. 4: 127 (2013).
- Nanba D, Toki F, Matsushita N, Matsushita S, Higashiyama S, and Barrandon Y. Actin filament dynamics impacts keratinocyte stem cell maintenance. EMBO Mol. Med. 5: 640-653 (2013).
- Barrandon Y, Grasset N, Zaffalon A, Gorostidi F, Claudinot S, Lathion Droz-Georget S, Nanba D, and Rochat A. Capturing epidermal stemness for regenerative medicine. Semin. Cell Dev. Biol. 23: 937-944 (2012).








