がん細胞の遺伝子変異不均一性に関する数理モデル解析
 研究代表者
研究代表者
岩本一成
大阪大学蛋白質研究所
http://www.protein.osaka-u.ac.jp/cell_systems/
研究概要
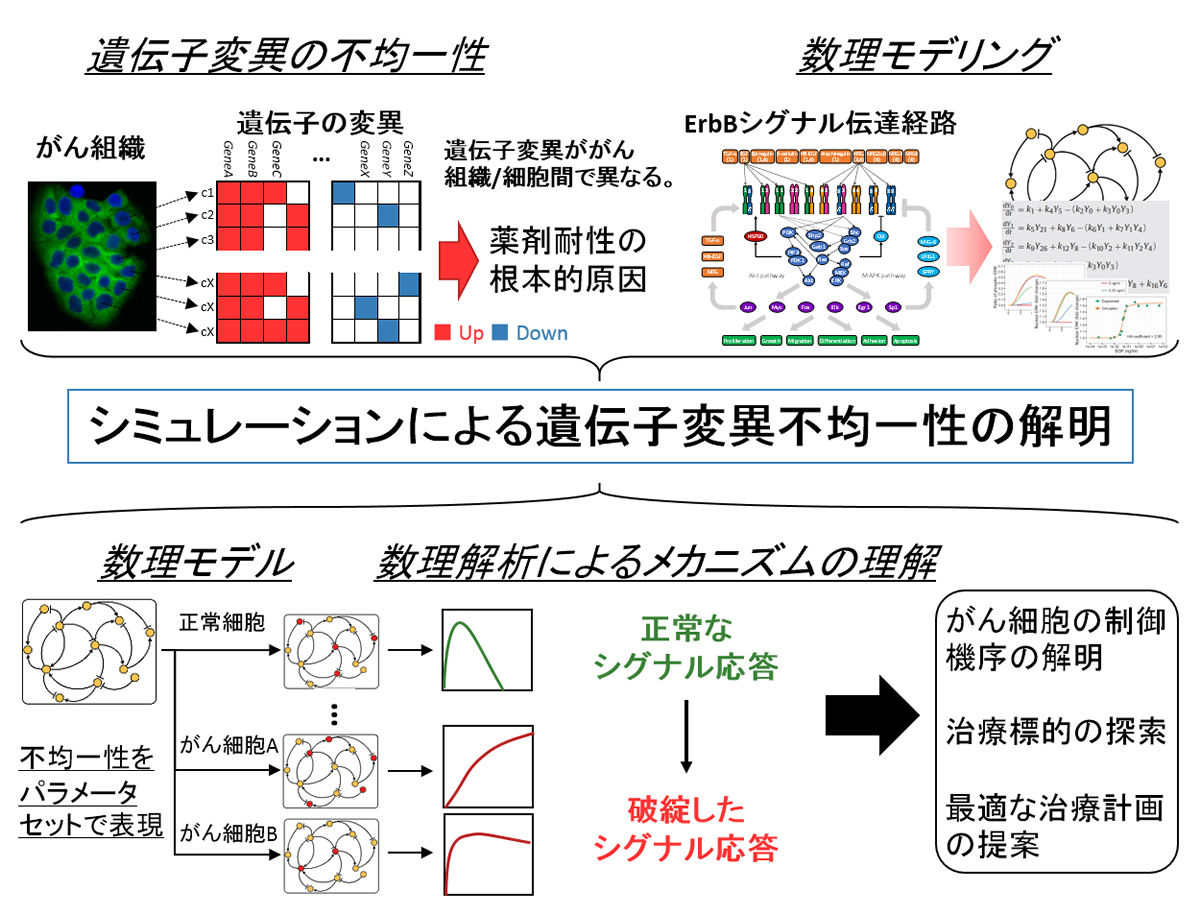
がんは重大な疾病の一つであり、これまでに細胞のがん化を誘導する遺伝子(ドライバー遺伝子)が数多く同定されてきた。多くのドライバー遺伝子は、細胞のシグナル伝達に関与しており、正常なシグナル伝達の破綻が細胞のがん化要因の一つであることが明らかにされている。近年、次世代シーケンサーの登場で、がん組織における遺伝子変異の網羅的計測が可能となり、ドライバー遺伝子変異のパターンが、がん組織間のみならず細胞間でも異なること(遺伝子変異の不均一性)が見出され(Curtis et al., Nature, 2012; Wang et al., Nature, 2014; Uchi et al., PLoS Genetics, 2015)、がん細胞ごとに異なるシグナル伝達の破綻が起きている事が示された。シグナル伝達の破綻様式の違いは、異なる薬剤感受性を生み出す。従って、このような不均一な集団は、組織として、薬剤抵抗性を獲得すると考えることができる。そのため、遺伝子変異の不均一性によるシグナル伝達の破綻様式の違いを明らかにすることは、がん組織の薬剤抵抗性機序の理解につながり、さらに新奇の薬剤治療標的の同定や既存治療薬の組み合わせ等の治療計画の一助となることが期待される。そこで、本研究課題では、数理モデリングや数値シミュレーション等の数理学的アプローチを用い、多くのがん組織で遺伝子変異が見られるErbBシグナル伝達経路を対象に、遺伝子変異の不均一性とシグナル伝達の破綻様式の解明を目指す。
初めに、ErbBシグナル伝達経路からその下流の細胞周期制御機構までを網羅する数理モデルを作成する。これまでに、ErbBシグナル伝達経路および細胞周期制御機構の多くの数理モデルが発表されており、それらの数理モデルの統合による新奇大規模数理モデルを構築する。遺伝子変異は、構築した数理モデルのキネティックパラメータ変化で表現し、不均一性はパラメータセットを複数準備することで再現する。また、遺伝子変異の不均一性は文献情報等に基づき決定する。パラメータセット毎に数値シミュレーションを行い、増殖速度(細胞周期の速度)、力学的な安定性、パラメータ感度、ロバストネス等の解析を実施する。そして、これらの解析結果を統合し、遺伝子変異の不均一性とシグナル伝達の破綻様式の関係を明らかにする。
参考文献
- Magi S*, Iwamoto K*, and Okada-Hatakeyama M, Current Status of Mathematical Modeling of Cancer - From the Viewpoint of Cancer Hallmarks, Curr. Opin. Syst. Biol., 2, 38-47. (2017)
- Iwamoto K, Shindo Y and Takahashi K, Modeling cellular noise underlying heterogeneous cell responses in the epidermal growth factor signaling pathway, PLoS Comp. Biol., 12(11): e1005222. (2016)
- Shindo Y, Iwamoto K, Mouri K, Hibino K, Tomita M, Kosako H, Sako Y and Takahashi K, Conversion of graded phosphorylation into switch-like nuclear translocation via autoregulatory mechanisms in ERK signaling, Nat. Comm., 7, 10485. (2016)
- Iwamoto K, Hamada H, Eguchi Y and Okamoto M, Stochasticity of intranuclear biochemical reaction processes controls the final decision of cell fate associated with DNA damage, PLoS ONE, 9, e101333. (2014)
- Iwamoto K, Hamada H and Okamoto M, Mechanism of cell cycle disruption by multiple p53 pulses, Genome Informatics, 25(1), 12-24. (2011)
- Iwamoto K, Hamada H, Eguchi Y and Okamoto M, Mathematical modeling of cell cycle regulation in response to DNA damage: Exploring mechanisms of cell-fate determination, BioSystems, 103, 384-391. (2011)








