オーロラキナーゼシグナル伝達の数理・遺伝学的解析
 研究代表者
研究代表者
五島剛太
名古屋大学大学院理学研究科
http://bunshi4.bio.nagoya-u.ac.jp/~tenure2/goshima.html
研究概要
本研究では、細胞分裂制御の鍵キナーゼ・オーロラによるリン酸化シグナルを通じた分裂制御機構の解明を目指して、2つの具体的目標を設定します。
① オーロラキナーゼの濃度勾配により高次微小管系構造体・分裂期スピンドルの長さが決まる仕組みを試験管再構成・数理解析により明らかにすること。
② 新奇の遺伝学的手法を開発してオーロラキナーゼの基質やオーロラ経路をバイパスするシグナル伝達経路・制御分子を探索すること。
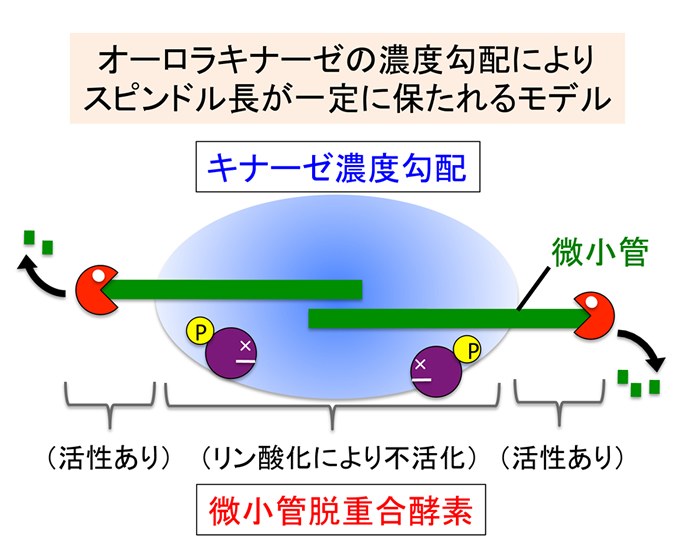
①「キナーゼ濃度勾配によるスピンドル長決定」モデルの構築
細胞内の高次構造体のサイズは多くの場合、細胞の種類に応じて決まっています。微小管フィラメントを主体とする複雑な構造体であるスピンドル(紡錘体)は、細胞分裂装置として機能し、その欠損は疾患の原因となっています。スピンドルの長さもまた細胞種によって厳密に規定されており、長さに影響を与える因子(たとえばKIF2A)の発現量と癌化との因果関係も議論されています。私たちはスピンドル長が決められる仕組みについて、遺伝学、細胞生物学、生化学、そして数理解析を用いて長年取り組んできました。そして2013年、オーロラキナーゼの濃度勾配(=リン酸化活性勾配)がスピンドルの長さを決定する重要な要因であるとの新たな説を提唱しました。3因子のみによるこのシンプルなモデルを導いた細胞および数理解析のデータは以下のとおりです。
- 細胞分裂後期のスピンドル中央にオーロラキナーゼが蓄積し、濃度勾配を形成した。
- オーロラキナーゼは微小管脱重合酵素KIF2Aをリン酸化し、これを不活化した。
- コンピュータシミュレーションでは、KIF2Aに削られたスピンドル微小管がオーロラキナーゼ活性の高い領域に入るとKIF2Aは活性を失い、さらなる脱重合は阻害された。すなわち、オーロラキナーゼの濃度勾配の度合いがスピンドル微小管の長さを決定した。
本研究では、オーロラキナーゼの濃度勾配による微小管長制御を試験管内で再現し、その定量データを組み入れた数理モデルを完成させることを目標とします。
②未同定のオーロラ基質、シグナル伝達経路の探索
オーロラキナーゼのスピンドル機能は多岐に渡り、さまざまな細胞種の増殖に必須です。私たちは、分裂酵母で新しいタイプの遺伝学実験系を立ち上げ、オーロラキナーゼの新規の基質やさらには、オーロラ機能を代替することのできるシグナル伝達経路を見出すことをもうひとつの目標とします。
参考文献
- Yamada, M., Tanaka-Takiguchi, Y., Hayashi, M., Nishina, M., and Goshima, G. (2017). Multiple kinesin-14 family members drive microtubule minus-end-directed transport in plant cells. J Cell Biol in press.
- Moriwaki, T., and Goshima, G. (2016). Five factors can reconstitute all three phases of microtubule polymerization dynamics. J Cell Biol 215, 357-368.
- Uehara, R., Kamasaki, T., Hiruma, S., Poser, I., Yoda, K., Yajima, J., Gerlich, D.W., and Goshima, G. (2016). Augmin shapes the anaphase spindle for efficient cytokinetic furrow ingression and abscission. Mol Biol Cell 27, 812-827.
- Watanabe, S., Shioi, G., Furuta, Y., and Goshima, G. (2016). Intra-spindle microtubule assembly regulates clustering of microtubule-organizing centers during early mouse development. Cell Rep 15, 54-60.
- Jonsson, E., Yamada, M., Vale, R.D., and Goshima, G. (2015). Clustering of a kinesin-14 motor enables processive retrograde microtubule-based transport in plants. Nat Plants 1, 15087.
- Nakaoka, Y., Kimura, A., Tani, T., and Goshima, G. (2015). Cytoplasmic nucleation and atypical branching nucleation generate endoplasmic microtubules in Physcomitrella patens. Plant Cell 27, 228-242.
- Ito, A., and Goshima, G. (2015). Microcephaly protein Asp focuses the minus ends of spindle microtubules at the pole and within the spindle. J Cell Biol 211, 999-1009.
- Miki, T., Naito, H., Nishina, M., and Goshima, G. (2014). Endogenous localizome identifies 43 mitotic kinesins in a plant cell. Proc Natl Acad Sci U S A 111, E1053-1061.
- Kamasaki, T., O'Toole, E., Kita, S., Osumi, M., Usukura, J., McIntosh, J.R., and Goshima, G. (2013). Augmin-dependent microtubule nucleation at microtubule walls in the spindle. J Cell Biol 202, 25-33.
- Uehara, R., Tsukada, Y., Kamasaki, T., Poser, I., Yoda, K., Gerlich, D.W., and Goshima, G. (2013). Aurora B and Kif2A control microtubule length for assembly of a functional central spindle during anaphase. J Cell Biol 202, 623-636.








