リゾホスファチジン酸受容体LPA6によるリガンド認識の構造基盤
石谷隆一郎(東京大学大学院理学系研究科・生物科学専攻)
Reiya Taniguchi, Asuka Inoue, Misa Sayama, Akiharu Uwamizu, Keitaro Yamashita, Kunio Hirata, Masahito Yoshida, Yoshiki Tanaka, Hideaki E. Kato, Yoshiko Nakada-Nakura, Yuko Otani, Tomohiro Nishizawa, Takayuki Doi, Tomohiko Ohwada, Ryuichiro Ishitani, Junken Aoki & Osamu Nureki
Structural insights into ligand recognition by the lysophosphatidic acid receptor LPA6.
Nature 548, 356-360 (17 August 2017) doi:10.1038/nature23448 [PubMed]
http://www.nature.com/nature/journal/v548/n7667/full/nature23448.html
[要約]
リゾホスファチジン酸はシグナル伝達に関わる脂質メディエーターの一種であり、6種のGタンパク質共役型受容体(LPA1–LPA6)を活性化することで細胞外から細胞内へとシグナルを伝える。本研究では、ゼブラフィッシュ由来のリゾホスファチジン酸受容体LPA6の結晶構造を3.2 Å分解能で決定した。LPA6が持つリガンド結合ポケットは、受容体の側面に向かって大きく開いており、脂質二重膜に面した領域にリゾホスファチジン酸分子の炭化水素鎖が結合することが推定された。この特徴的な構造と、ドッキングシミュレーション、変異体解析に基づき、LPA6によるリガンド認識機構のモデルを提唱した。本研究より得られた示唆は、脂質性リガンドによるシグナル伝達を理解する上での基盤情報となることが期待される。
[背景]
リゾホスファチジン酸(lysophosphatidic acid: LPA)は、リン酸基とグリセロール骨格からなる親水性頭部に対して一本の炭化水素鎖が結合した分子構造を持つ脂質メディエーターである。これまでに、6種のGタンパク質共役型受容体(GPCR)がLPA受容体として同定されており、それらの受容体の生理機能の解析が近年進展している。特に、LPA分子によるシグナル伝達は、細胞増殖や細胞遊走などの細胞応答を引き起こすことが分かっており、肺線維症や癌などの疾患にも関与する。そのため、LPA受容体は創薬標的タンパク質としても注目されてきた。
6種のLPA受容体は、アミノ酸配列の違いからLPA1、LPA2、LPA3からなるEDGファミリーとLPA4、LPA5、LPA6からなるnon-EDGファミリーに二分される。2ファミリー間で、受容体の生理的な機能や阻害剤化合物に対する応答性は異なっている。この違いは受容体の立体構造やリガンド認識機構の大きな違いに基づくものと予想されており、故に両ファミリーに属する受容体について、立体構造やリガンド認識機構を理解することが必要であった。しかし、2015年にLPA1の立体構造が報告された一方で、non-EDGファミリーのLPA受容体の立体構造は現在までに明らかとなっておらず、LPA分子の認識機構は未解明であった。
[研究成果]
本研究では、異なる生物種に由来するnon-EDGファミリーのLPA受容体のうち、高い発現量と安定性を示したゼブラフィッシュ由来LPA6(以下zLPA6)を構造解析に用いた。リガンド非存在下で結晶が得られ、3.2 Å分解能でzLPA6の結晶構造を決定した。
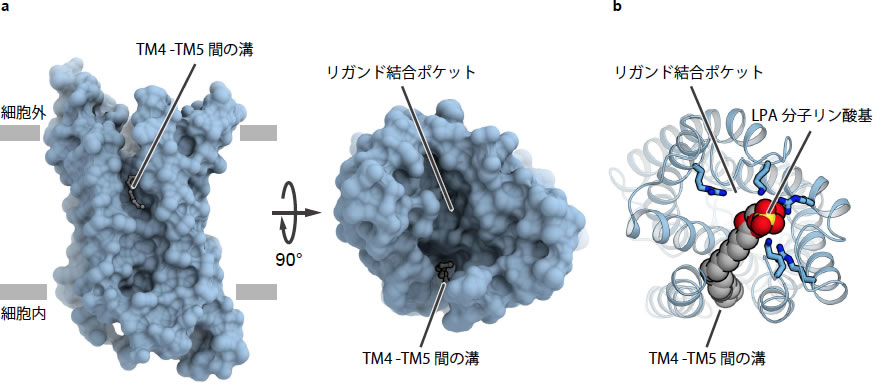
図1 zLPA6の全体構造とリゾホスファチジン酸のドッキングモデル
(a) zLPA6の全体構造。脂質膜中からと細胞外から見た図を示した。
(b) zLPA6とリゾホスファチジン酸のドッキングモデル
zLPA6の結晶構造の中央部分には、細胞外側に向かって開いたリガンド結合ポケットが形成されていた(図1a)。ポケット内部には疎水的な環境が形成されていた一方、ポケットの周縁部分にはアルギニンなどの正電荷を帯びたアミノ酸残基が存在していた。LPA分子が負電荷を帯びたリン酸基を持つことから、これらの正電荷を帯びたアミノ酸残基がLPA分子の認識に関わることが予想された。
受容体中央のリガンド結合ポケットを取り囲む膜貫通ヘリックス(TM)のうち、TM4とTM5の間には隙間ができており、脂質二重膜の中央付近から細胞外側に続く縦に長い溝が形成されていた(図1a)。受容体中央のリガンド結合ポケットはこの溝とつながっており、溝部分を開口部としてリガンド結合ポケットが脂質二重膜側に向かって開いている、という極めて特徴的な構造をとっていた。このTM4とTM5の間に形成された溝の内部には、lipidic cubic phase法に際して用いた脂質分子に由来する電子密度が観測された。このことから、TM4とTM5の間の溝内部にLPA分子の炭化水素鎖が収容されると予想された。
得られた立体構造を用いて行ったリガンドドッキングシミュレーションでも、上記の予想に合致するLPA分子の結合モデルが得られた(図1b)。また、このモデルに基づきzLPA6の変異体を作成したところ、正電荷を帯びたアミノ酸残基の変異体やTM4とTM5の間の溝に面した位置のアミノ酸残基の変異体で、受容体活性やLPA分子との結合能が低下した。以上の実験結果に基づき、zLPA6は、LPA分子のリン酸基をリガンド結合ポケットの周縁部に位置している正電荷を持つアミノ酸残基で認識し、LPA分子の炭化水素鎖部分をTM4とTM5の間に形成された溝の形状で認識している、というリガンド認識機構のモデルを提唱した(図2)。また、構造既知の他のGPCRとの構造類似性に基づき、受容体へのLPA分子の結合に伴って起こるTM6とTM7の構造変化が受容体活性化に重要であることが予想された。以上のようなLPA分子認識機構や受容体活性化機構は、LPA1のものとは大きく異なっており、EDGファミリーとnon-EDGファミリーのLPA受容体間での性質や機能の違いの構造基盤が明らかになった。
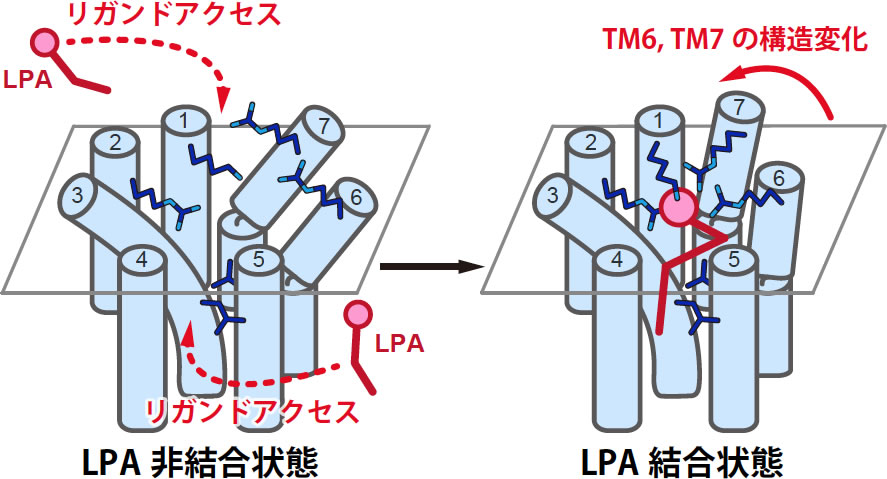
図2 zLPA6によるリゾホスファチジン酸認識機構のモデル図
想定されるリガンドアクセス経路と、LPA分子の結合により誘起される構造変化を赤矢印で図示した。
脂質受容体については、疎水性が高いリガンドが受容体の側方から、脂質二重膜を通ってリガンド結合ポケットに入り込む、“lateral access”の可能性がこれまで提唱されてきた。今回zLPA6のリガンド結合ポケットが脂質二重膜に向かって大きく開いていることが明らかになったことで、この“lateral access”の可能性が強く支持された。実際、細胞を用いての実験より、脂質膜中のLPA分子量が増えるとリガンド非添加状態でもヒトLPA6が活性化することを確認しており、この実験結果からも、LPA分子がLPA6に対して受容体側方からアクセスする可能性が高いと考えられる。
以上のように、本研究ではzLPA6の特徴的な立体構造を足がかりに、受容体によるLPA分子認識機構を推定することができた。この研究成果は脂質受容体による脂質分子認識機構の理解を大きく進めるものである。本研究より明らかになった知見を基盤情報として活用することで、脂質分子によるシグナル伝達機構の詳細について新たな視点から迫っていくことが可能になると期待される。








